总压对化学平衡的影响zongya dui huaxue pinghengde yingxiang
在温度一定时,改变体系的总压,可能引起平衡点的移动,也可能导致某些反应谓衡常数的改变,对不同反应类型其影响是不同的,可分3种情况:
❶理想气体反应 其平衡常数Kp(或Kc)仅仅是温度的函数,当温度一定时,Kp为定值,不随压力而变化。但其平衡常数Kx为温度和压力的函数,即
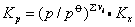
对Σvi≠0的反应,总压变化将影响Kx而影响体系的平衡组成。对Σvi>0的反应,若总压增大,则(p/p) Σvi增大,Kx减小,即平衡时产物摩尔分数减小,反应物摩尔分数增大,表明平衡向左移动。因Σvi>0表示反应后体系的体积增大,所以增大总压,平衡向减小体积的方向移动。对Σvi<0的反应,若总压增大,则(p/p)Σvi减小,Kx增大,平衡时产物摩尔分数增大,反应物摩尔分数减小,表明平衡向右移动,也是向着体积减小的方向移动。对Σvi=0的反应,因 (p/p)Σvi=1,则Kp=Kx,故总压对平衡无影响。
❷真实气体反应 其平衡常数一般用Kf表示。
根据
Kf=Kp·Kψ
式中 Kf——逸度平衡常数。
Kψ——逸度系数按平衡常数形式的组合,它是
T,p的函数。
Kf只是温度函数,总压变化虽然不改变Kf,但Kp和Kψ都会受影响,不过它们受到压力的影响恰好相互抵消。因此对真实气体反应,改变体系总压只引起平衡点移动。
❸ 对凝聚相反应 当压力较小时,压力变化对其平衡常数的影响可忽略,平衡点也不会随之移动。若压力很大,根据平衡常数与压力的关系,即普朗克方程
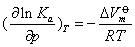
式中 △
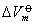 ——在标准状态下体系发生 1 mol反应前后体积的变化
——在标准状态下体系发生 1 mol反应前后体积的变化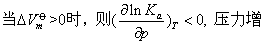
大,Ka值减小,平衡时产物活度减小,反应活度增大,表明平衡向左移动。
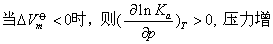 大,Ka值变大,对正向反应有利。
大,Ka值变大,对正向反应有利。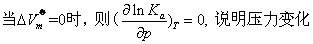 对平衡常数无影响。
对平衡常数无影响。上述结论与平衡移动原理一致,即压力增大,平衡向减小体积的方向移动。