氨an
化学式NH3。角锥形分子,键角为106.75°。无色气体,有强烈的刺激气味。熔点为-77.3℃,沸点为-33℃,密度为 0.7710g· L-1(101.325kPa 下)。在同族中从分子量看,沸点显得特别的高,这与氢键有关。高温时会分解成氮和氢。溶于水、乙醇和乙醚。水溶液称为氨水,呈弱碱性。氨是极性分子,易液化,在 101.325kPa 下冷至-33℃以下或常温下加压至7×105Pa以上,即可变为无色液体,也易被固化成雪状固体。液态氨蒸发时吸收大量热,可做致冷剂。液态氨与水性质很相似,也存着自身电离平衡:
 和氮化物,它们都可看成是氨的衍生物。氨也可以氨基或亚氨基取代其他化合物中的原子或原子团。氨还有两种重要的取代衍生物,联氨 (肼) NH2NH2和羟氨 (胲) NH2OH。由于氨中氮的氧化数最低 (-Ⅲ) 故氨具有还原性,通常被氧化为氮,例如,氨在纯氧中燃烧发出黄色火焰产生水和氮:
和氮化物,它们都可看成是氨的衍生物。氨也可以氨基或亚氨基取代其他化合物中的原子或原子团。氨还有两种重要的取代衍生物,联氨 (肼) NH2NH2和羟氨 (胲) NH2OH。由于氨中氮的氧化数最低 (-Ⅲ) 故氨具有还原性,通常被氧化为氮,例如,氨在纯氧中燃烧发出黄色火焰产生水和氮:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
氯或溴也可在气态或溶液中把氨氧化成氮:
2NH3+3Cl2=6HCl+N2
氨可被次氯酸氧化,产物取决于反应介质的pH值,当pH值小于3时,产物是三氯化氮NCl3; 当pH值为3~5时,产物是二氯亚氨基NHCl2; 当pH值大于8时,产物是氯化氨基NH2Cl。氨也可被氧化性酸所氧化。故氧化性酸的铵盐热分解就是这类氧化还原反应,例如:
NH4NO2=N2+2H2O
NH4NO3=N2O+2H2O
(NH4)2Cr2O7=N2+Cr2O3+4H2O
氨An
氮和氢的化合物,化学式NH3,无色有刺鼻气味的气体,熔点—77.7℃,沸点—33.35℃,易溶于水,在0℃时,1体积水可以溶解1000体积氨,氨的水溶液称为氨水,具有弱碱性。氨水中氨与水结合形成一水合氨并电离产生铵离子和氢氧根离子。
氨与酸作用可以生成铵盐。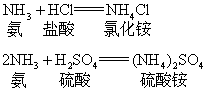
氨的主要用途是制造氮肥和硝酸。氨水可用作氮肥,多种铵盐如硝酸铵、硫酸铵、碳酸氢铵等均可用作氮肥。高效氮肥尿素也是以氨为主要原料制造的。氨还可以用作致冷剂。
在炼焦厂干馏煤的过程中,能产生氨气,工业上氨主要采用合成法生产,在高温、高压和催化剂存在下,让氮气和氢气直接化合形成氨。
在实验室中,将铵盐与碱共热可制备氨气。