碱土金属元素jiantu jinshu yuansu
周期系ⅡA族,包括铍、镁、钙、锶、钡、镭6种元素。铍是稀有元素,镭为放射性元素。它们的基本性质见表。
碱土金属单质具有金属光泽,是电的良导体。铍非常坚硬,能刻划玻璃。碱土金属是活泼金属,能直接或间接与电负性较大的非金属元素,如卤素、硫、氧、磷、氮、氢等形成相应的化合物。铍和镁与水作用时,表面生成致密的氧化物保护膜,因而对水稳定。钙、锶、钡容易与水作用。在干态下,碱土金属具有很强的还原性,例如在高温下钙和镁常作为还原剂。碱土金属的氧化物都是白色固体,经过煅烧的氧化铍和氧化镁难溶于水,而氧化钙、氧化锶、氧化钡同水猛烈反应,生成相应的氢氧化物并放出大量热。除铍外,其余元素均可生成过氧化物。除铍、镁外,其余元素均可生成超氧化物。碱土金属的氢氧化物均为白色固体,在水中的溶解度较小。氢氧化铍是两性氢氧化物,氢氧化镁是中强碱,氢氧化钙、氢氧化锶、氢氧化钡是强碱。碱土金属的盐类在常温下均为热稳定性盐,盐的离子键特征随着碱土金属离子半径的增大,键的离子性也增强。碱土金属的氯化物、硝酸盐易溶于水,碳酸盐、草酸盐、磷酸盐都是难溶盐,硫酸盐、铬酸盐溶解度差异较大。碱土金属的碳酸盐、草酸盐、铬酸盐、磷酸盐均能溶于稀硝酸和稀盐酸中。挥发性的碱土金属化合物在火焰中显示特征颜色,如钙显砖红色,锶显洋红色,钡显黄绿色,镭显深红色,可利用火焰颜色来检验这些元素。
碱土金属元素的基本性质
| 元 素 | 铍Be | 镁Mg | 钙Ca | 锶Sr | 钡Ba |
| 原子序数 相对原子质量 价电子层结构 原子半径/pm 离子半径/pm 密度(293K) /g·cm-1 熔点/℃ 沸点/℃ 第一电离势/kJ·mol-1 第二电离势/kJ·mol-1 第三电离势/kJ·mol-1 | 4 9.012 2s2 89 31 1.848 1283 2970 900 1757 14849 | 12 24.305 3s2 136 65 1.738 648.8 1107 738 1451 7733 | 20 40.078 4s2 174 99 1.55 839 1484 590 1145 4912 | 38 87.620 5s2 191 113 26 769 1384 550 1064 4210 | 56 137.330 6s2 198 135 3.5 725 1140 503 965 |
| M2-(g)水合焓/kJ·mol-1 电负性 | 2520 1.57 | 1960 1.31 | 1615 1.00 | 1475 0.95 | 1340 0.89 |
标准电极电势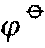 /V /VM2-(ag)+2e⇌M(s) | -1.85 | -2.36 | -2.87 | -2.89 | -2.91 |