离子独立运动定律lizi duli yundong dinglu
在无限稀释的溶液中,电解质的摩尔电导率为组成其正离子和负离子的摩尔电导率之和。其数学表达式为
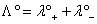
式中λ°+和λ°-——无限稀释溶液中正离子和负离子的摩尔电导率
该定律是F.W.G.柯尔劳许于1876年提出的。他从强电解质溶液的实验中发现,由两种不同的正离子和相同的任一种负离子所组成的两种盐,其极限摩尔电导率之差为一定值。例如:
电解质的摩尔电导率 25℃
 ×104/(S·m2·mol-1) ×104/(S·m2·mol-1) | |||||||
| c/(mol·L-1) | NaCl | KCl | HCl | NaAc | 1/2H2SO4 | HAc | NH4OH |
| 0.000 0 0.000 5 0.001 | 126.45 124.50 123.74 | 149.86 147.81 146.95 | 426.16 422.74 421.36 | 91.0 89.2 88.5 | 429.6 413.1 399.5 | 390.71 67.7 49.2 | 271.4 47 34 |
| 0.005 | 120.65 | 143.55 | 415.80 | 85.72 | - | 22.9 | 16 |
| 0.01 | 118.51 | 141.27 | 412.00 | 83.76 | 336.4 | 16.3 | 11.3 |
| 0.05 | 111.06 | 133.37 | 399.09 | 76.92 | - | 7.4 | 5.1 |
| 0.10 | 106.74 | 128.96 | 391.32 | 72.80 | 250.8 | - | 3.6 |
| 1.00 | 111.9 | 332.8 | 49.1 | - | - | - | |
吴万伟

由两种不同的负离子和相同的任一种正离子所组成的两种盐,其极限摩尔电导率之差亦为一定值。例如:

于是,F.W.G.柯尔劳许认为: 在无限稀释的溶液中,每种离子是独立运动的,不受其他离子的影响。任一离子对强电解质的摩尔电导率的贡献是一定的,与其他的离子的存在及本性无关。依离子独立运动定律,弱电解质的Λ°可以以强电解质的Λ°间接计算得到。例如,已知Λ°NaAc` Λ°HCl和Λ°NaCl,则可计算出Λ°HAc。因为
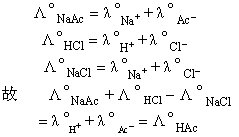
如果知道无限稀释溶液中各种离子的极限摩尔电导率,亦可直接利用Λ°=λ+°+λ°-计算电解质的摩尔电导率。
离子的极限摩尔电导率,可通过测定Λ°和无限稀释时的离子迁移数t0’+’t0’-按下式计算(见右表)。

在无限稀释溶液中离子的极限摩尔电导率 25℃
| 正离子 | λ°+/S·m2·mol-1 | 负离子 | λ°/S·m2·mol-1 |
| H+ | 349.82×10-4 | OH- | 198.0×10-4 |
| Li+ | 38.69×10-4 | Cl- | 76.34×10-4 |
| Na+ | 50.11×10-4 | Br- | 78.4×10-4 |
| K+ | 73.52×10-4 | I- | 76.8×10-4 |
| NH+4 | 73.4×10-4 | NO3- | 71.44×10-4 |
| Ag+ | 61.92×10-4 | CH3COO- | 40.9×10-4 |
| 1/2Ca2+ | 59.50×10-4 | ClO-4 | 68.0×10-4 |
| 1/2Ba2+ | 63.64×10-4 | 1/2SO2-4 | 79.8×10-4 |
| 1/2Sr2+ | 59.46×10-4 | ||
| 1/2Mg2+ | 53.09×10-4 | ||
| 1/3La3+ | 69.6×10-4 |