酶mei
具有催化作用的蛋白质,已知的酶均为球状蛋白质,其相对分子质量范围在1万~100万之间,一些酶已提纯得到结晶。酶按其催化的反应分类与命名,一般分为水解酶 (如淀粉酶、蛋白酶)、氧化还原酶、转移酶、异构酶、合成酶等。
酶是生物催化剂,它的主要特点: ❶专一性,一种酶只催化一种反应;
❷化学选择性,在混合物中,仅催化某种化合物的反应;
❸立体选择性,反应后形成具有一定立体构型的化合物;
❹酶催化的反应条件温和,不需强酸强碱、高温高压,强氧化剂与强还原剂,一般在常温、常压、pH=7左右即可反应;
❺催化效率高,能使一些反应的速度很大。总之,酶是生命活动的基础,凡有生命之处,就有酶的作用。在一个活的细胞中,同时进行着几百种不同的反应,都是在酶的催化下进行的。
有些酶的催化作用,需要辅酶配合。辅酶是一些低分子有机物 (如血红素、叶绿素、维生素等),有些酶还常与金属离子形成配合物。
酶促反应也可以在生物体外进行,有些酶促反应已应用于酿造业和化工生产。工业生产用的酶主要从微生物发酵获得,可以把酶固定在某些载体上,形成固定化酶,以提高生产中酶的回收率。
酶mei
活细胞产生的生物催化剂,其绝大部分是高度特化了的蛋白质;参与生物体内几乎所有的化学反应。可以说,没有酶的催化作用,也就没有机体的新陈代谢,生命也就不存在了。酶具有一般催化剂的特性:只能使可能进行的反应加速,而不能催化根本不能进行的反应,也不改变可逆反应的平衡点;只需微量就能显著地加快化学反应速度,但反应终了时本身复原而不被消耗。酶又具有区别于一般催化剂的特性:首先,酶的催化效率很高,对同一反应,酶催化的反应速度比非生物催化剂高106~1013倍;酶所催化的反应(酶促反应),要求适合生物活动的比较温和的条件;一般说来,一种酶只催化一种或一种类型的特定的生化反应,这就是所谓酶的专一性,也是酶和一般无机催化剂的一个最大的不同之处;最后,酶本身也要进行新陈代谢,其合成量和催化活性都受细胞和生物体的调节控制。已知的酶已有数千种。国际上按反应性质将酶分成氧化还原酶、转移酶、水解酶、裂合酶(或裂解酶)、异构酶、合成酶(或连接酶)等6大类。一般使用酶的习惯名称,包括底物(酶所作用的物质)和反应类型两个因素,有时还加上来源和其他特点,但不要求特别精确,水解酶类则通常省去“水解”字样。如胃蛋白酶、木瓜蛋白酶、酸性磷酸酶、乳酸脱氢酶、蔗糖酶、脂肪酶等。过去无数实践都证实“酶是蛋白质”,而且许多酶学理论是建立在这个认识基础上的。但是,从80年代初期起陆续发现一些具有催化特性的核糖核酸(RNA),在这方面作出了杰出贡献的美国的悉尼·奥尔特曼(Altman)和托马斯·切赫(Cech)共同获得了1989年度诺贝尔化学奖。最近,其他实验室已人工合成了具有
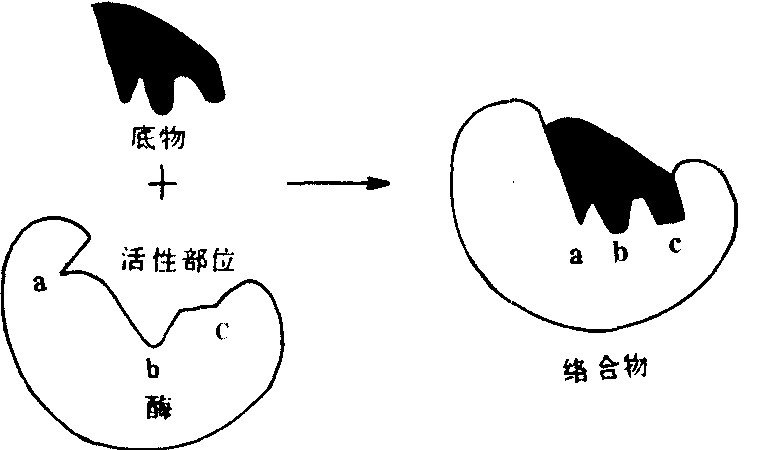
图524 酶和底物结合的锁钥学说
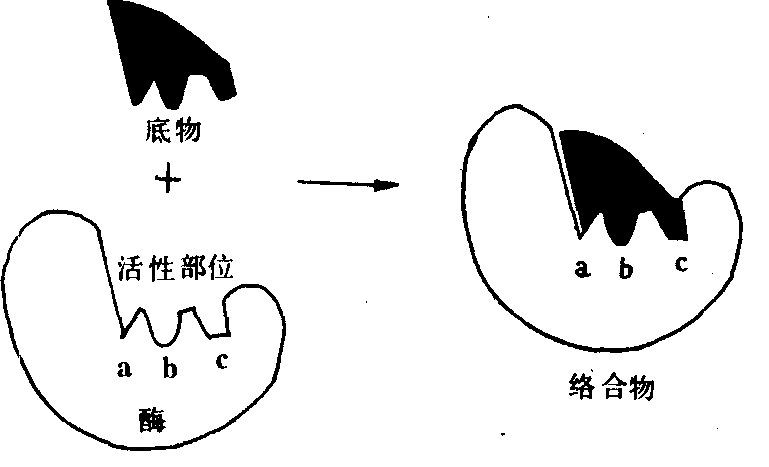
图525 酶和底物结合的诱导契合学说
催化活力的19寡聚核苷酸。多数酶是结合蛋白质,除含有对热不稳定的酶蛋白部分外,还含有对热稳定的非蛋白质小分子物质,叫做酶的辅因子。酶蛋白和辅因子单独存在时无催化活性,二者结合成全酶后才具有活性。酶的辅因子可以是金属离子,也可以是小分子有机化合物,常见的有Mg2+、Ca2+、Cu+、Zn2+、Fe2+等金属离子和维生素的衍生物。酶蛋白部分主要决定酶的专一性,而辅因子部分主要决定酶促反应的类型。某一特定的辅因子,往往可以与不同的酶蛋白结合构成酶促反应类型相同而专一性不同的酶。如辅因子与酶蛋白结合较松,易将二者分开时,又将辅因子叫做辅酶。关于酶的作用方式,有一个重要的理论,就是酶底物络合物(中间产物)学说。该学说认为:酶(E)在催化某一反应时,首先与底物(S)可逆地结合成一种酶底物络合物ES。接着底物被激活,也即底物中的化学键被活化了,ES变成ES*(激活状态);然后ES*再分解生成产物P,并释放出自由的酶E。整个过程可表示为:E+S 。酶作为蛋白质,其分子要比大多数底物大得多。由此可以想见,在反应过程中酶与底物的接触只限于酶分子上的少数基团或较小的部位,许多研究也支持这种看法。酶分子表面的、与催化活性直接有关的、具特定三维结构的小区域叫做酶的活性部位(或活性中心)。这个区域能专一地结合底物并催化底物生成产物。构成活性部位的氨基酸残基,在肽链上可能相距甚远,甚至位于不同肽链上,但当酶蛋白形成特定空间结构时,通过肽链盘绕、折叠,彼此靠近,形成具有一定空间结构的区域。如果酶是结合蛋白质,其辅基或辅酶上的某一部分结构,往往也是活性部位组成部分。除活性部位外,对于维持酶的空间构象等必需的那些基团,也是保持酶的催化活性和稳定性所必要的。对所有这些残基的任何修饰或破坏,都会损伤或降低酶的活性。酶对底物的专一性很高,只能催化一定结构或与一些结构近似的化合物进行反应。因此有的学者认为,底物的外形必须与酶的活性部位吻合,就像锁和钥匙的关系一样,提出“锁钥学说”。后来发现某些酶的活性部位并不是僵硬的结构,又有人提出了“诱导契合”学说。认为:酶的活性部位的结构有一定的可塑性,当底物分子和酶接近时,在其诱导下,酶活性部位上的有关基团达到正确的排列和定向,使其构象发生了有利于与底物结合的变化,于是酶和底物互补契合,结合成络合物,促使底物发生反应。酶促反应速度可以用单位时间内底物的消耗量或产物的生成量来表示。许多因素可以影响酶促反应的速度,如酶浓度、底物浓度、温度、pH、激活剂、抑制剂等。酶不仅在生物的代谢活动中起重要的作用,而且在实际中得到广泛的应用。酶的催化效率高,专一性强,不发生副反应,作用条件又温和。所以,在生命科学的研究工作中常作为工具酶使用,如蛋白质和核酸的各种内切酶和外切酶;血液或组织液中酶活性的测定,已成为诊断疾病的重要辅助手段,如利用测血中转氨酶活性,协助诊断心肌梗塞和肝病。有些酶制剂还可作为药物使用,如常用胰酶制剂治疗消化不良。酶在工业上的应用,更是多方面的,如蛋白酶制剂用于皮革的脱毛、蚕丝的脱胶;淀粉酶制剂用于纺织品的脱淀粉浆;加酶洗涤剂用于去除蛋白类污物等。现在已有些酶经物理或化学方法处理制成不溶于水的固定化酶(固相酶),使其不但便于保存、反复使用、有利连续生产,而且稳定性也有所增加。
。酶作为蛋白质,其分子要比大多数底物大得多。由此可以想见,在反应过程中酶与底物的接触只限于酶分子上的少数基团或较小的部位,许多研究也支持这种看法。酶分子表面的、与催化活性直接有关的、具特定三维结构的小区域叫做酶的活性部位(或活性中心)。这个区域能专一地结合底物并催化底物生成产物。构成活性部位的氨基酸残基,在肽链上可能相距甚远,甚至位于不同肽链上,但当酶蛋白形成特定空间结构时,通过肽链盘绕、折叠,彼此靠近,形成具有一定空间结构的区域。如果酶是结合蛋白质,其辅基或辅酶上的某一部分结构,往往也是活性部位组成部分。除活性部位外,对于维持酶的空间构象等必需的那些基团,也是保持酶的催化活性和稳定性所必要的。对所有这些残基的任何修饰或破坏,都会损伤或降低酶的活性。酶对底物的专一性很高,只能催化一定结构或与一些结构近似的化合物进行反应。因此有的学者认为,底物的外形必须与酶的活性部位吻合,就像锁和钥匙的关系一样,提出“锁钥学说”。后来发现某些酶的活性部位并不是僵硬的结构,又有人提出了“诱导契合”学说。认为:酶的活性部位的结构有一定的可塑性,当底物分子和酶接近时,在其诱导下,酶活性部位上的有关基团达到正确的排列和定向,使其构象发生了有利于与底物结合的变化,于是酶和底物互补契合,结合成络合物,促使底物发生反应。酶促反应速度可以用单位时间内底物的消耗量或产物的生成量来表示。许多因素可以影响酶促反应的速度,如酶浓度、底物浓度、温度、pH、激活剂、抑制剂等。酶不仅在生物的代谢活动中起重要的作用,而且在实际中得到广泛的应用。酶的催化效率高,专一性强,不发生副反应,作用条件又温和。所以,在生命科学的研究工作中常作为工具酶使用,如蛋白质和核酸的各种内切酶和外切酶;血液或组织液中酶活性的测定,已成为诊断疾病的重要辅助手段,如利用测血中转氨酶活性,协助诊断心肌梗塞和肝病。有些酶制剂还可作为药物使用,如常用胰酶制剂治疗消化不良。酶在工业上的应用,更是多方面的,如蛋白酶制剂用于皮革的脱毛、蚕丝的脱胶;淀粉酶制剂用于纺织品的脱淀粉浆;加酶洗涤剂用于去除蛋白类污物等。现在已有些酶经物理或化学方法处理制成不溶于水的固定化酶(固相酶),使其不但便于保存、反复使用、有利连续生产,而且稳定性也有所增加。酶enzymes
生物体内产生的具有催化功能的蛋白质,又称生物催化剂。生物体内的化学反应几乎都是在酶催化下以很高的速度和明显的方向性进行的。酶和一般催化剂一样,在相对低的浓度下,仅能加快化学反应的速度,而不改变化学反应的平衡点,并在反应前后本身不发生变化。酶又具有不同于一般催化剂的特点: ❶酶有很高的催化效率。在常温常压和中性pH条件下,以分子比为基础,酶的催化效率比一般催化剂高107至1013倍。
❷酶有较高的专一性。一种酶只催化一种或一类反应物(又称底物)转变成一定的产物。根据所催化反应的类型、底物的性质及空间结构,酶的专一性可分为反应专一性、底物专一性和立体专一性三类。
❸酶促反应的条件温和。例如,在人工条件下,分子氮还原成氨的反应需要高温高压,而当有腺苷三磷酸(ATP)存在时,固氮酶在常温常压下可催化同样的反应。但是,凡能使蛋白质变性的物理和化学的因素都可能使酶变性而失去催化作用。
❹酶的催化作用在生物体内受到各种因素调节以维持生命化学过程的有序性。
早在数千年前,中国人民就会酿酒、造酱、制醋和制饴,其生产工艺实际上都与当时尚未认识的酶对发酵过程的催化有关。近代最早关于酶的文献记载是1833年佩伊(P.Payer)和珀查斯(J.F.Persoz)从麦芽抽提液的酒精沉淀物中获得淀粉酶制剂的报道。1878年,库奈(W.Kuhne) 引入了酶(enzyme)一字,以代表“在酵母中” 的催化剂。约半个世纪后,萨纳(J. B.Sumner) 1926年从刀豆中提取并结晶了脲酶,成为纯化酶蛋白的先驱。迄今在生物体内已发现有2 000多种酶。近年又发现了具有催化功能的核糖核酸,使人们对于生物催化剂的化学本质的认识有了新的发展。
命名与分类 根据1961年国际生化会议 (IUB,The International Union of Biochemistry)酶委员会(EC,The Enzyme Commission)关于酶的命名原则,每个酶可有一个习惯名称和一个系统名称。习惯名称的命名以催化反应的底物和反应类型为依据,通俗易懂,为人们所惯用。例如,作用于蛋白质的酶称为蛋白酶,催化基团移换的酶称为转移酶。系统名称的组成包括正确的底物名称、底物构型和反应类型,后以“酶”字结尾。例如,习惯名称为谷丙转氨酶的酶的系统名称为L-丙氨酸:α-酮戊二酸氨基转移酶。两个底物名称之间用冒号(: )分开。上述机构还规定把酶分为氧化还原酶类、转移酶类、水解酶类、裂解酶类、异构酶类和合成酶类六大类。每一大类之下,又分为若干亚类、亚亚类。在该分类系统中,每个酶都有四个数字的编码,前冠EC( 酶委员会)。四个数字分别表示该酶所属的大类、亚类、亚亚类和在亚亚类中的编排次序,以便检索,例如谷丙转氨酶的编码为EC,2,6,1,1。
酶活性 酶催化反应的能力。用酶促反应的速度衡量,所测定的酶促反应速度一般为初速度。酶活性通常以国际单位表示。在特定条件下,一分钟内催化一微摩尔底物转变的酶量定为一个国际单位。特定条件指对酶的催化活性最适的温度、酸碱度和饱和的底物浓度。每毫克酶制剂所含有的酶的国际单位数称为酶的比活性,表示酶的纯度。在特定条件下,一摩尔酶一分钟内转变底物的摩尔数称为酶的转换值或摩尔活力。
化学组成 酶的化学本质是蛋白质。按其化学组成,酶可分为简单蛋白质和结合蛋白质两类。简单蛋白质酶类除了蛋白质以外不含任何其他物质,例如胰蛋白酶。而占酶的大多数的结合蛋白质酶类则由蛋白质和非蛋白质的小分子物质两部分所组成。其中蛋白质部分称为酶蛋白,非蛋白质的小分子物质称为辅助因子。只有当酶蛋白和辅助因子结合成全酶时,结合蛋白质酶类才表现出催化活性。辅助因子包括辅基、辅酶以及金属离子。辅基、辅酶是对热稳定的有机小分子,有20种左右。根据与酶蛋白结合的松紧程度不同,凡与酶蛋白结合牢固,不易分离的称为辅基,例如细胞色素氧化酶的铁卟啉; 而结合松弛,易于分离的称为辅酶,例如脱氢酶的辅酶Ⅰ和辅酶Ⅱ。绝大多数辅基和辅酶的化学组成与维生素和核苷酸有关 (见维生素)。金属离子的作用在于稳定酶蛋白分子的空间构象或作为酶与底物结合的桥梁或参与催化过程中氢和电子的传递。
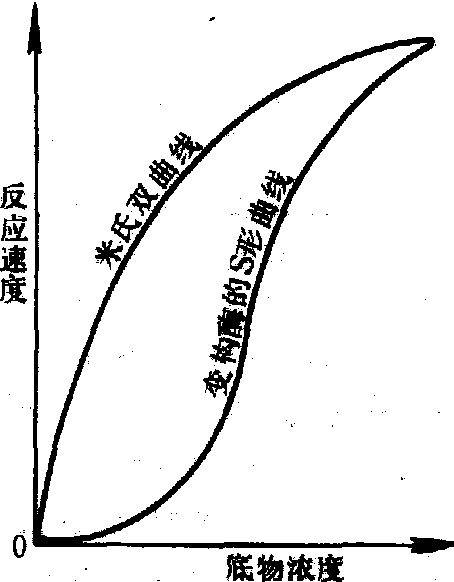
酶促反应的速度与底物浓度的关系
按其分子结构,酶又可分为单体酶、寡聚酶、变构酶、多酶复合体系和同工酶等。单体酶只有一条肽链组成。这类酶很少,一般为水解酶类,如溶菌酶和胃蛋白酶。寡聚酶则由两个至几十个亚基组成,分子量由几万至几百万。其中以在调节代谢反应的速度方面有重要作用的变构酶图形(见图)。多酶复合 最有代表性。其特点是在酶的不同亚基上存在有空间上分离而功能上相关的催化部位和变构部位。各种代谢调节物,如中间代谢物、药物等通过与其变构部位结合,引起亚基间的相互作用而使催化部位的活性发生变化。变构酶在反应速度和底物浓度关系上表现为S形动力学曲线 体系则是功能上密切有关的几个酶彼此嵌合,高效率地催化若干反应定向进行的复合体。例如脂肪酸合成酶系由六个酶和一个脂酰基载体蛋白组成,同工酶是指催化相同的化学反应,但分子结构不同的一类酶。例如乳酸脱氢酶的同工酶具有五种分子形式,是由两种亚基组成的四聚体。由于分子结构上的差异,同工酶常表现出不同的理化性质。在动植物组织中已知的同工酶有500多种。
催化机理 酶分子上与催化活性有关的基团称为必需基团。若干与底物直接结合并催化底物发生反应的必需基团构成的微区称为酶的活性中心。构成活性中心的必需基团,按其功能可相对地分为结合基团和催化基团。前者决定酶的专一性,后者决定酶所催化反应的性质。有些基团兼有两者的作用。对结合蛋白质酶类而言,辅助因子通常是活性中心的组成部分。构成活性中心的必需基团可能分别位于同一条肽链的不同部分或不同的肽链上。由于肽链的盘绕和折叠,它们的空间位置互相接近以形成活性中心,而活性中心以外的必需基团则在维持酶蛋白的空间结构中起作用。有些蛋白水解酶,如消化酶和凝固血液的酶,在细胞中合成后起初呈无活性状态、称为酶原。借特定的蛋白水解作用,切除酶原上一定的肽段,使其剩余部分形成活性中心才表现出催化活性。这种酶原由非活性结构状态转变为活性结构状态的作用称为酶原的激活。
酶加速化学反应的基本原因,是酶的参与改变了反应原来的程序,降低了反应的活化能。有证据表明,在此过程中酶首先与底物结合形成过渡性的不稳定的中间复合物,后者再进行反应生成产物和释放出酶。反应过程可表示为:
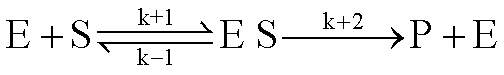
式中 E表示酶; S表示底物;ES表示酶与底物的中间复合物; P为产物; k表示速度常数。酶与底物形成中间复合物以降低反应活化能的观点是目前探索酶作用机理的基本出发点。一般认为,酶分子的催化基团与底物分子相应部位通过互相靠近和趋向达到诱导契合; 底物分子的某些化学键的稳定性受酶分子作用而削弱; 酶分子中某些氨基酸残基侧链作为质子的受体或供体起酸碱催化作用,以及某些酶与底物之间形成共价中间产物等因素都可能降低反应的活化能而加速酶促反应的速度。
影响酶活性的因素 酶的催化活性受到酶浓度、酸碱度、温度、底物浓度以及激活剂与抑制剂等因素的影响。在有足够底物存在而其他因素一定时,酶的催化活性与酶浓度成正比。溶液的酸碱度可以通过改变酶及其底物分子上极性基团的解离状态而影响酶与底物中间复合物的形成,从而改变酶的催化活性。使酶具有最大催化活性的pH,称为酶的最适pH。偏离最适pH的过酸或过碱的情况都会削弱酶的活性。大多数酶的最适pH在6.5~8之间,但一个酶的最适pH可因其来源、纯度、底物性质和缓冲系统不同而改变。一般地说,在一定的温度范围内,酶的活性随温度升高而增高,超过一定温度界限时,由于热变性使酶的活性下降。使酶具有最大催化活性的温度称为酶的最适温度。酶的最适温度受反应时间的影响,反应时间越短,最适温度较高,反之则较低。
当酶浓度、温度和pH一定时,在底物浓度很低的范围内,酶促反应的速度与底物浓度呈正比。当底物浓度达到一定程度,所有酶全部与底物结合后,反应速度达到最大值,此时再增加底物浓度也不能使反应速度增加,反应速度与底物关系呈双曲线形 (见图),其数学关系式为米氏(Michaelis-Meten)方程:
U=V〔S〕/(km+〔S〕)
式中
U表示反应初速度; V为最大反应速度; S为底物浓度;km为米氏常数。米氏常数是酶的特征性常数,为U=1/2V时的底物浓度,对不同的底物酶有不同的米氏常数,其数值近似地反映出酶与底物的亲和力,米氏常数越大,酶与底物的亲和力越小,反之则越大。
酶促反应因加入某些物质使酶活性增加的现象称为激活作用,这类物质称激活剂。激活剂一般有两种,一种为维持酶活性所必需的,如某些金属离子,称为必需激活剂; 另一种则是对酶已有的活性有增强的作用,称为非必需激活剂。有些物质能使酶分子的必需基团的化学性质发生改变,引起酶活性降低或丧失,这种现象称为抑制作用,这类物质称抑制剂。根据抑制剂与酶的作用方式以及抑制作用是否可逆,抑制作用可分为不可逆抑制作用与可逆抑制作用两类。在不可逆抑制作用中,抑制剂通常以比较牢固的共价键与酶蛋白中的必需基团结合而使酶失去活性,并且难以通过物理的方法除去抑制剂使酶活性恢复。例如有机磷农药可通过与昆虫体内的胆碱酯酶的丝氨酸羟基不可逆结合使之失活而引起昆虫神经中毒致死。在可逆抑制作用中,抑制剂与酶蛋白的必需基团可逆结合,因而被抑制的酶活性易于恢复。根据抑制剂与底物的关系,可逆抑制分为竞争性和非竞争性等类型。在竞争性抑制中,抑制剂为天然底物结构上的类似物,通过与天然底物竞争酶的活性中心从而抑制其催化能力。例如,磺胺类药物与合成叶酸的原料对氨基苯甲酸结构相似,可以作为细菌叶酸合成酶的竞争性抑制剂发挥抗菌作用。竞争性抑制作用可以通过增加底物浓度而消除。在非竞争性抑制中,抑制剂与酶活性中心以外的必需基团结合从而抑制酶的催化能力,但并不影响酶与底物的结合,因此增加底物浓度不能消除其抑制作用。
酶的应用 酶在生物代谢活动中的重要性说明,没有酶也就没有生命。研究酶的性质及其催化机理对于了解生物的代谢规律,探索动植物代谢异常和病害的酶学机制有重要理论意义。光合与固氮、作物与畜禽的繁育、疾病的防治等无不与酶密切有关。活细胞产生的酶经分离纯化后在体外可继续其功能使酶在食品、发酵、乳业、纺织、制革和制药工业以及医学和环境科学中有重要的应用价值。
酶Mei
具有催化作用的蛋白质。已知的酶有2 000多种。生物体内发生的化学反应绝大多数是在酶催化下进行的。酶的催化作用常需要辅酶配合,有些还需要金属离子配合。
酶催化反应有显著的特点,它不需要高温、高压、强酸、强碱、强氧化剂等剧烈的条件,一般只在常温、常压下反应,却有极高的催化效率。酶促反应也可以在生物体外进行,并已应用于工业生产。
酶
简称“Enz”。由生活细胞产生的,起生物化学反应催化剂作用的蛋白质。酶的特异性决定其所催化反应的数目和类型。酶划分为氧化还原酶类、转移酶类、水解酶类、裂合酶类、异构酶类和连接酶类等。
酶enzyme
又称生物催化剂。生物体内产生的具有催化功能的蛋白质。是生物体内进行代谢反应不可缺少的物质。许多酶在催化反应时,往往还需一些小分子有机物或金属离子等辅助因子参与。也有些酶的组分中含有核糖核酸,甚至发现完全由核糖核酸组成的生物催化剂。使反应能在常温、常压和中性pH值条件下进行,且可大大加快反应进程。对底物(反应物)有专一性,催化反应的能力可以调节控制。根据催化反应的类型,可以分为六大类:氧化还原酶类,转移酶类,水解酶类,裂解酶类,异构酶类和合成酶类。酶学研究对生命现象本质的揭示,疾病的诊断和治疗,以及工农业生产等都有极重要意义。
酶
生物体内产生的具有催化功能的特殊蛋白质。酶的催化效率比一般催化剂高107至1013倍。酶具有专一性,其专一性分为反应专一性、底物专一性和立体专一性3类。现已在生物体内发现2000多种酶。分为氧化还原酶、转移酶、水解酶、裂解酶、异构酶、合成酶6大类。
酶
具有催化作用的蛋白质,是一种生物催化剂。一切生物细胞内部都含有酶。酶是生物体进行新陈代谢的最基本条件,没有酶,生物体的新陈代谢就不能进行,生命也就结束。酶能够促进细胞内各种类型的化学反应,它具有高度专一性,并且催化效率很高,一个酶分子在一分钟内能催化数百万个作用物分子的转化。酶的作用条件一般在常温、常压、近中性的水溶液中进行,强酸、强碱和高温条件就会使酶失去催化能力。酶的种类非常多,分布在细胞的不同部位,起着不同的催化作用。如果缺少必需的酶,细胞中特定的代谢过程就不能进行。酶的本质是蛋白质,所以它本身不能复制自己,而要在特定基因的指导下才能合成出来。