二氧化碳eryanghuatan
化学式CO2,俗名碳酸气,也称碳酸酐或碳酐。常温下无色,是 一种略有酸味的气体,熔点为-56.6℃ (5.2×105Pa),密度为1.977g· L-1,临界温度为 31.04℃,临界压力为72.85×105Pa,25℃时溶解度为0.1449g。二氧化碳分子具有直线型结构O=C=O,键长为116.3pm,是非极性分子,与N-3,N2O,NO+2,OCN-等互为等电子体。液态二氧化碳密度为1.101g·cm-3,使液态二氧化碳减压膨胀,一部分迅速蒸发吸收大量的热,可使另一部液态二氧化碳凝固成白色雪状固体,俗称干冰。干冰是分子晶体,在-18.5℃时不经熔化即可直接升华,而且蒸发较慢,可得-80℃左右的低温,常用做冷冻剂。二氧化碳化学性质很稳定,通常不分解放氧,也不与氧气反应,加上比空气重,是常用灭火剂。活泼金属如钾、钠、镁、锌等可在二氧化碳中燃烧,如:
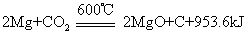
CaCO3+2HCl=CaCl2+CO2↑+H2O
工业上是用煅烧石灰石或酒精发酵时的副产物来制取: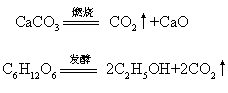
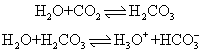
二氧化碳Eryang huatan
又称碳酸气、碳酐,分子式CO2。无色无味无臭气体,无毒,比空气重,密度是空气的1.5倍。二氧化碳易溶于水,水溶液为碳酸。常温下加压,二氧化碳能液化为无色透明液体,或凝成白色固体,固体二氧化碳叫“干冰”。二氧化碳不易分解,较稳定,不与氧反应,不助燃。高温时,活泼金属如钾、钠、镁、锌等能在二氧化碳气体中燃烧。例如:镁与二氧化碳反应为:Mg+CO2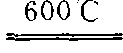 2MgO+C。有机物燃烧、发酵,人和生物呼吸时都产生二氧化碳,工业上用煅烧石灰石来制取大量二氧化碳,实验室制取二氧化碳时,用盐酸和碳酸钙反应。二氧化碳的主要用途:❶液体二氧化碳可作灭火剂,气化时能迅速将温度降低,并能使空气与火焰隔绝而灭火。
2MgO+C。有机物燃烧、发酵,人和生物呼吸时都产生二氧化碳,工业上用煅烧石灰石来制取大量二氧化碳,实验室制取二氧化碳时,用盐酸和碳酸钙反应。二氧化碳的主要用途:❶液体二氧化碳可作灭火剂,气化时能迅速将温度降低,并能使空气与火焰隔绝而灭火。
❷金属的气割气焊时,用二氧化碳气体作保护气,防止熔融金属氧化。
❸制造饮料、汽水要用二氧化碳气体。
❹干冰能升华,即不经液化直接气化,能使温度降到-80℃左右,可作致冷剂,冷藏食品,也可在农业上,用飞机播撒干冰,人工降雨。
二氧化碳
俗称碳酸气。无色、无毒,略有刺鼻气味及微酸味的气味。可供工业用的二氧化碳气源有2类。一类为天然二氧化碳气源,如某些天然气田。另一类为副产气源,主要来自5个方面:❶制氨和制氢装置;
❷在啤酒、白酒和发酵法酒精生产过程中产生的发酵气体;
❸石灰煅烧;
❹烟道气;
❺有关工业能产生二氧化碳的生产过程中。二氧化碳气体经加压(7.6 MPa)、冷却(约32℃)可以液化。将液态二氧化碳冷却到-56.6℃以下、压力降到接近0.1 MPa时可以固化并压成冰块或冰丸。固体二氧化碳又称干冰。二氧化碳用途广泛,主要用于化工、炼钢、冷藏、灭火、爆破采矿和制取清凉饮料等5~6方面。大气中二氧化碳含量过高,达到600 mL/m3以上时,易使地球表面和大气层下沿温度升高,导致所谓“温室效应”,对生态环境产生不利影响。