不可逆反应bukeni fanying
参见“可逆反应”。化学平衡条件 (huaxue pingheng tiaojian) 对等温等压下的任一化学反应
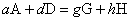
若体系发生一个极微小的变化,以至认为参与反应各物质的组成未变,因而各组分的化学势也不变。这时反应体系自由焓的变化完全取决于各物质的物质的量的微小变化。由吉布斯方程
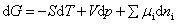
因反应在等温等压下进行,则
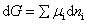
式中μi为任一组分的化学势; dni为任一组分的物质的量的微小变化。
由反应进度的定义,对上述反应,则有
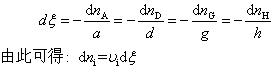
式中vi对产物取正值,对反应物取负值。因而
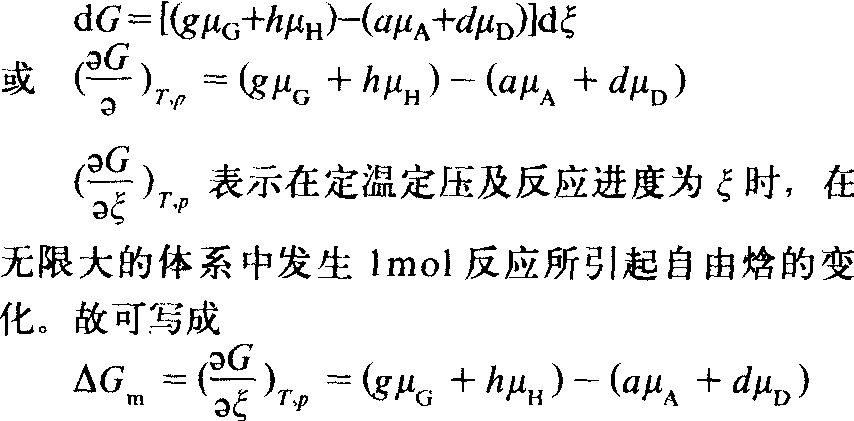
式中 △Gm——反应摩尔自由焓对 一般化学反应,可表示为
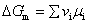
由于化学反应是在等温等压下进行,且不做非体积功,△Gm可作判据。所以
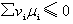
此式表明: 如果产物的化学势总和小于反应物的化学势总和,则正向反应为自发; 如果产物的化学势总和大于反应物的化学势总和,则逆向反应为自发; 如果产物的化学势总和等于反应物的化学势总和,则化学反应达到平衡。因此,化学反应谓衡的条件是
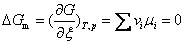
即反应摩尔自由焓等于零。
反应自由焓与反应进度有关,见G-ξ图。
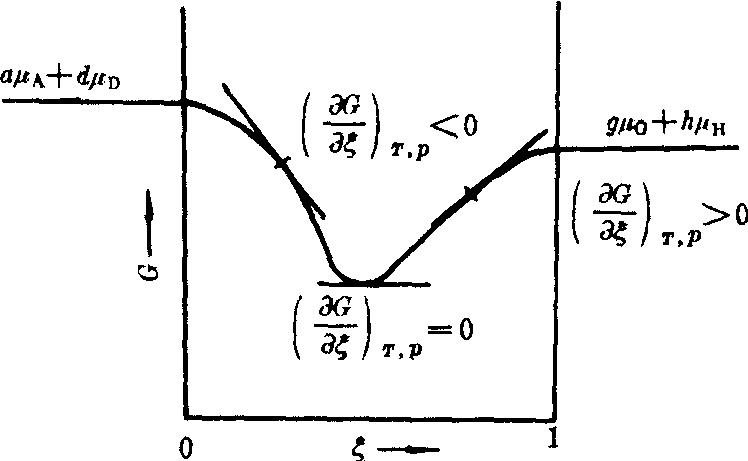
G-ξ示意图

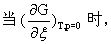 反应体系处于平衡。因反应开始时ξ=0,G为最大值,这时反应趋势最大。随着反应的进行,ξ逐渐增大时,曲线斜率绝对值逐渐减小,或G逐渐减小。达到化学平衡时,G减小到最小值,则△Gm等于零。若将处于曲线极小点 (平衡点) 的反应体系进行电解,体系将离开平衡点,进行自由焓增加的反应,即反自发反应。若电解一旦停止,反应的自发仍使G减小,直至回到平衡态为止。
反应体系处于平衡。因反应开始时ξ=0,G为最大值,这时反应趋势最大。随着反应的进行,ξ逐渐增大时,曲线斜率绝对值逐渐减小,或G逐渐减小。达到化学平衡时,G减小到最小值,则△Gm等于零。若将处于曲线极小点 (平衡点) 的反应体系进行电解,体系将离开平衡点,进行自由焓增加的反应,即反自发反应。若电解一旦停止,反应的自发仍使G减小,直至回到平衡态为止。化学平衡,从动力学看,在一定条件下,可逆反应的正向速率等于逆向速率,是两个相反的化学作用所达到的动态平衡状态; 从热力学看,化学平衡是反应体系的宏观性质不再随时间而变化的状态,是化学反应的限度,即反应体系处于宏观静止的状态。