氯的氧化物lu de yanghuawu
氯与氧的二元化合物总称,也称为氧化氯。一氧化二氯Cl2O,二氧化氯ClO2,六氧化二氯Cl2O6,七氧化二氯Cl2O7等,都是很活泼、不稳定的物质。形成时皆吸热,高浓度时易爆炸。已能全部直接合成。氧化氯较重要的物理性质见下表。
一氧化二氯 结构式为角形,夹角111°,是次氯酸的酐,溶于水生成次氯酸,一氧化二氯液态时与还原剂接触即发生爆炸,纯净的液体可以加热蒸馏而不分解,在气态时加热即爆炸,分解成氧和氯。将氯气通入新制备的干燥氧化汞上即制得一氧化二氯:
HgO+2Cl2=HgCl2+Cl2O
二氧化氯 结构式为角形,夹角116.5°,液体呈红棕色,是强氧化剂和氯化剂。主要用于水的净化,它做漂白剂效果比氯高2.5倍。二氧化氯遇到还
氧化氯的物理性质
| 名称和化学式 | 一氧化二氯 Cl2O | 二氧化氯 ClO2 | 六氧化二氯 Cl2O6 | 七氧化二氯 Cl2O7 |
| 颜 色 分子量 熔点/℃ 沸点/℃ 气化热/kJ·mol-1 蒸气压/Pa 相对密度 | 黄棕气体 86.914 -116 2 25.94 93 192 | 黄绿气体 67.457 -59 11.0 27.28 65 328 1.64(0℃) | 深红液体 166.914 3.5 213 (计算) 39.75 41.33 2.02(3.5℃) | 无色液体 182.914 -91.5 80 34.69 3 160 1.86(0℃) |
2KClO3+H2C2O4=K2CO3+CO2↑+H2O+2ClO2↑
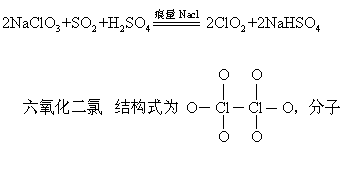
Cl2O6+2MOH=MClO4+MClO3+H2O
它是混合酸酐。是臭氧氧化二氧化氯时得到的。七氧化二氯 结构式是两个三氧化氯由一个氧桥键连接Cl—O—Cl,夹角为128°,是高氯酸的酐,与水作用生成高氯酸。七氧化二氯较其他氯氧化物稳定,但加热和撞震可爆炸。氧化性比其他氧化物弱。可由高氯酸脱水来制取:
2HClO4+P2O5=Cl2O7+2HPO3