渗透压强shentou yaqiang
纯溶剂和溶液被半透膜隔开时,因渗透而产生的压强,简称渗透压。溶液的渗透压等于溶液和纯溶剂被半透膜隔开时,加在溶液上的恰能阻止纯溶剂进入溶液的压强。它也等于溶液中溶质的分压强。产生渗透压的原因是:溶液与纯溶剂之间的半透膜只允许溶剂透过而不允许溶质透过,当半透膜两侧的溶液与纯溶剂平衡时,不是两侧的总压强相等,而是纯溶剂的压强等于溶液中溶剂的分压强。由于开始时半透膜两侧纯溶剂的压强与溶液中溶剂的分压强不相等,这个压强差提供了渗透压。渗透压相当于同样数量的溶质气化后被压缩在同溶液一样的体积内时所表现出来的压强。因此,渗透压一般都具有较大的数值。例如,10-3米3水溶解0.02千克糖所产生的渗透压约为1.37×105帕。溶液越浓,其渗透压越大。
如果溶液是不导电的稀薄溶液,则可以导出渗透压满足的公式。把稀薄溶液中的溶质分子近似看作气体系统中的分子,根据理想气体状态方程把溶质分子组成的“气体”压强表示为
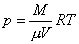
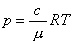
渗透压在生物体内广泛存在,例如人体内的肠壁是半透膜,有的盐(例如硫酸钠)不能通过肠壁,就会在肠中产生渗透压,从而把人体组织中的水分吸入肠中。喝咸海水不解渴也与渗透压有关,人喝咸海水后,由于产生了渗透压,因而不仅不能把水供给身体组织,还要夺取人体内的水分随尿一起排出体外。