热量reliang
物体间或物体各部分之间由于存在温度差而传递的能量。历史上当热质说占统治地位时,人们曾错误地认为“热”是一种物质称为热质,热量即热质的量,并定义了热量的单位“卡”。热力学第一定律建立后,揭示了热量是热接触中由于温度差而传递的能量,热量与传热的过程有关,它不是热力学系统状态的函数,而仅仅在系统状态发生变化时才有意义,因此不能说物体处在某个状态时含有多少热量。喀喇氏在1909年提出,由热力学第一定律来定义热量,这样可以使热量的定义完全摆脱热质说的影响。首先他不用热量的概念而给绝热过程下了一个纯粹力学的定义,即一个过程,其中物体状态的改变完全是由机械的或电的直接作用的结果,而没有受到其他影响的过程称为绝热过程。其次,由绝热过程的功定义了内能,由实验可知只要是绝热过程,系统从初态Ⅰ到终态Ⅱ外界对系统所作的功数值相同,与实施绝热过程的途径无关,因此可以引入系统状态函数——内能(U),绝热过程中系统内能的增量等于外界对系统所作的功U2-U1=A。进一步,如果系统不绝热,则系统内能的增量不等于外界所作的功,二者之差定义为热量Q=(U2-U1)-A。热量和功相当,都是被传递着的能量,其区别在于作功同系统在广义力作用下产生广义位移相联系,即同系统各部分的宏观运动相联系,而传热是分子间或分子与电磁场相互作用的结果,是和物质的微观运动相联系的。热量的数值可通过热容量(或比热)及温度的变化计算得出,对于一微小的变化过程dQ=CdT,或dQ=mcdT,dQ是被传递的热量,C为某过程的热容,dT为系统热力学温度的变化,m为物体的质量,c为物质的比热。对一个有限过程,则Q=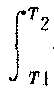 CdT,一般热容C与温度有关,在温度范围不太大时可看作常数,则Q=C(T2-T1)。国际单位制规定热量、功、能量的单位相同,都是“焦耳”(J)。
CdT,一般热容C与温度有关,在温度范围不太大时可看作常数,则Q=C(T2-T1)。国际单位制规定热量、功、能量的单位相同,都是“焦耳”(J)。
热量
定量描述热作用的物理量。在温度不同的物体间,热量总是从高温物体传递给低温物体。即使是在等温过程中,物体间温度也不断出现微小的差别,通过热量传递而不断达到新的平衡。它的SI单位是焦耳,历史上定义热量单位为卡。