理想气体状态方程lixiang qiti zhuangtai fang-cheng
习惯上称气态方程。理想气体是人们假想的,这种气体在分子间没有相互作用力,分子本身不占体积。一定质量的理想气体在始态时的压力、体积、热力学温度分别是p1,V1,T1,经过某一变化过程到终态时分别变成p2,V2,T2,气体从始态到终态、可以经过不同变化途径,设想经过一个等温过程,再经过一个等压过程。在第一个变化过程中,温度T1保持不变,压力从p1变成p2,体积从V1变成Va,根据玻意耳定律: 恒温时,一定质量的气体,体积与它承受的压力成反比p1V1=p2Va 或

在第二个变化过程中,当压力P2保持不变时,温度从T1变成T2,体积从Va变成V2,根据盖·吕萨克定律: 恒压下,一定质量的气体,它的体积与热力学
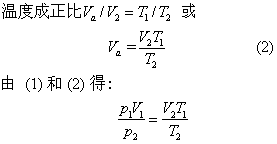
或
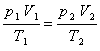
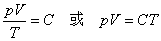
1mol任何理想气体在标准状态下(p0=1.013×105Pa,T0=273K,V0=22.4L)的气体常数R=p0V0/T0,将nmol理想气体(标准状况)占有的体积v0=nV0代入上述气体状态方程可得
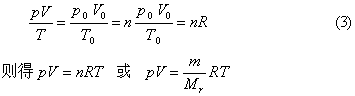
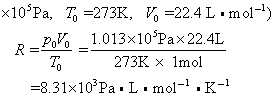
摩尔气体常数的单位和数值
| p | V | T | n | R |
| 帕(Pa) | 升(L) | 开(K) | 摩尔(mol) | 8.31×103 Pa·L·mol-1·K-1 |
| 帕(Pa) | 米3(m3) | 开(K) | 摩尔(mol) | 8.31 Pa·m3mol-1·K-1=8.31J·mol-1·K-1 |
| 大气压* | 升 (L) | 开(K) | 摩尔(mol) | 0.082 atm·L·mol-1·K-1 |
| 大气压* | 毫升 (mL) | 开(K) | 摩尔(mol) | 82 atm·mL·mol-1·K-1 |
| 毫米汞柱* | 毫升 (mL) | 开(K) | 摩尔(mol) | 62359 mmHg·ml·mol-1·K-1 |
| 达因·厘米-2* dyn·cm-2 | 厘米3(cm3) | 开(K) | 摩尔(mol) | 8.31×107 erg·mol-1·K-1 |
* 现已禁用