磷酸盐linsuanyan
磷(V)的含氧酸盐,包括正磷酸盐、焦磷酸盐和偏磷酸盐,通常指正磷酸盐。正磷酸为三元中强酸,可形成3种盐,即正盐 (如磷酸钠) 和两种酸式盐 (如磷酸二氢钠和磷酸氢二钠)。可利用酸碱中和反应原理来制备这些盐,如:
2H3PO4+Na2CO3=2NaH2PO4+CO2+H2O
H3PO4+Na2CO3=Na2HPO4+CO2+H2O
Na2HPO4+NaOH=Na3PO4+H2O
磷酸氢二钠水溶液 (0.1mol· L-1) 的pH值约为9.8,制备时,主要靠控制溶液中的pH值 (实际pH=8即可),从水溶液中析出的是结晶水合物Na2HPO4· 12H2O。它主要用于鞣革、印染、造纸、釉药、电镀、医药等方面。磷酸钠主要用于冶金、化工、纺织及锅炉内的水处理 (防止锅垢沾在管壁上) 等。除钠、钾、铵等的正磷酸盐和酸式盐易溶于水外,几乎所有的磷酸正盐和一氢酸式盐都难溶于水 (如磷酸钙与磷酸一氢钙),但所有的二氢酸式盐都易溶于水 (如磷酸二氢钙),磷酸二氢钙溶解度比磷酸 一氢钙大,故前者用做磷肥时肥效快,后者的肥效慢但持续性长。制作这两种磷肥是将磷灰石与硫酸按物质的量 (摩尔) 1:2或1:1作用,分别发生如下反应:
Ca3(PO4)2+2H2SO4=2CaSO4↓+Ca(H2PO4)2
Ca3(PO4)2+H2SO4=CaSO4↓+2CaHPO4
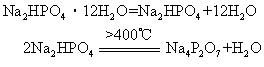
焦磷酸盐多用于电镀工业。链状三聚磷酸钠Na5P3O10可这样制取:
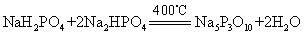
6H3PO4+5Na2CO3
=4Na2HPO4+2NaH2PO4+5CO2↑+5H2O
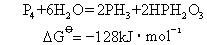
3HPH2O2=2H2PHO3+PH3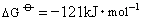
4H2PHO3=PH3+3H3PO4
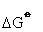 =4kJ·mol-1在热溶液中,膦可挥发出来,分解可进行到底。故磷是不稳定的,经过各步可水解为磷酸与膦。
=4kJ·mol-1在热溶液中,膦可挥发出来,分解可进行到底。故磷是不稳定的,经过各步可水解为磷酸与膦。