缓冲溶液huanchong rongye
对于外界因素(如加酸、加碱或稀释) 能在一定程度上起对抗作用,而保持溶液酸度或pH值基本不变的溶液叫做缓冲溶液。缓冲溶液通常由弱酸和弱酸盐 (如HAc和NaAc)、弱碱和弱碱盐 (如NH3和NH4Cl) 以及不同碱度的酸式盐 (如NaH2PO4和Na2HPO4) 等组成。
缓冲溶液具有调节溶液酸度或碱度的能力,可以HAc-NaAc缓冲液为例加以说明。因HAc和NaAc有共同离子Ac-,体系中存在同离子效应,溶液中氢离子浓度的计算公式为:
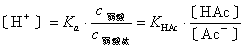
表明溶液中 〔H+〕 只取决于酸、盐浓度的比值。若在溶液中加入少量强酸,则强酸的H+与溶液中的Ac-结合形成HAc分子,使溶液中Ac-的浓度稍有减小,HAc浓度稍有增大,由于加入强酸的量很小,引起酸,盐浓度比的改变很小,因此溶液的氢离子浓度或pH值基本保持不变。若在溶液中加入少量强碱,则强碱与等量的HAc发生中和反应,生成醋酸盐,使溶液中HAc的浓度略为减小,Ac-浓度略为增大,引起酸、盐浓度比的改变也很小,根据上式溶液中的氢离子浓度或pH值基本上仍保持不变。将缓冲溶液稀释时,弱酸和弱酸盐的浓度同时成比例减小,比值不变,所以不影响溶液的pH值。
各种缓冲溶液有不同的缓冲容量,缓冲溶液中缓冲混合物的浓度比 (如〔HAc〕/〔Ac-〕) 越趋近于1,它们的浓度越大,则溶液的缓冲容量越大。缓冲容量可以用改变缓冲溶液1个pH单位所需加入的酸量或碱量 (mol·L-1) 表示。将上式取负对数可得:
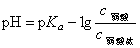
当 c弱酸/c弱酸盐=1时,pH=pKa。当c弱酸/c弱酸盐比值从0.1到10时,pH=pKa±1,所以弱酸和它的盐、弱碱和它的盐配制成缓冲溶液时,有一定的pH值有效范围,例如HAc+NaAc缓冲溶液的pH值范围: pH=pKa±1=-1g(1.8×10-5)±1=4.74±1,即pH值范围是3.74~5.74。在此范围内溶液的缓冲作用较大。
缓冲溶液
能抵抗外加少量强酸、强碱或稍加稀释的影响,本身pH值不发生显著变化的溶液。它有三种类型:弱酸—弱酸盐,弱碱—弱碱盐,以及多元弱酸的酸式盐及其对应的次级盐的水溶液。