酸碱质子论suan jian zhizi lun
1923年布朗斯特和劳莱提出了新的酸碱理论——质子论,克服了阿氏酸碱水离子论的局限性,不仅适用于水溶液体系,也适用于非水体系和无溶剂体系,扩大了酸碱的范围。
❶酸碱的定义 质子论认为,能给出质子H+的分子或离子都是酸; 能接受质子的分子或离子都是碱。例如,HCl,NH+4,H2PO-4等都是酸,NH3,NaOH,CO2-3,Ac-等都是碱。酸和碱不是彼此孤立,酸给出质子就变成碱; 碱得到质子又可变成酸。即,酸![]() 碱+质子,例如
碱+质子,例如
酸 碱
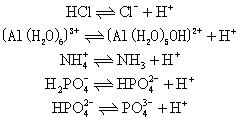
❷ 酸碱反应和酸碱平衡 根据质子论,任何酸碱反应都是两个共轭酸碱对之间的质子传递反应,例如:
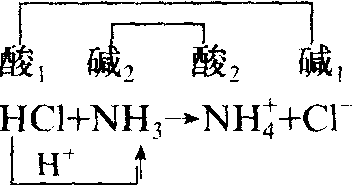
因此,有质子传递的平衡过程,如溶剂的自偶电离平衡、弱酸和弱碱的电离平衡以及盐类的水解平衡,全都可以纳入酸碱平衡的范畴。对这些酸碱平衡中的质子传递过程可分析如下:

❸酸、碱的强度 质子论选用一种两性的溶剂作为基准酸或基准碱来衡量其他酸、碱的强度。例如,用水作为基准碱,与各种酸反应: 各种酸+水
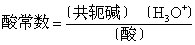
酸碱质子论的适用范围较酸碱-水离子论扩大了很多,但对于无质子溶剂 (如液态SO2,SOCl2等)中的酸碱反应,还是不能解释,因此质子论仍有一定的局限性。