分压定律的计算fenya dinglu dejisuan
均匀混合气体的压力等于各组分气体的分压力之和,称道尔顿分压定律,简称分压定律,它只适用于理想气体。所谓组分的分压力,是指在混合气体中占有与该组分相同的物质的量,在相同温度下,单独占有相同体积时的压力。混合气体中的两种组分的分压和物质的量分别用p1,p2,n1,n2表示。气态方程式分别用于各组分,在相同状况下,p1V=n1RT,p2V=n2RT,所以p1/p2=n1/n2,表明在相同状况下,两种气体的压力比等于它们的物质的量比。
例 某一定体积的密闭容器中,放入8mol氢气、4mol氮气,某温度下反应达到平衡,尚有3.2mol氢气,问❶平衡时容器内的压力是反应前压力的百分之几?
❷若平衡体系压力是2.026×107Pa,求氨气的分压。
解❶设反应前后气体总物质的量和总压力分别为n始,n平,p始,p平,则

❷ 设平衡时氨的分压力和物质的量分别为p(NH3),n(NH3),则:
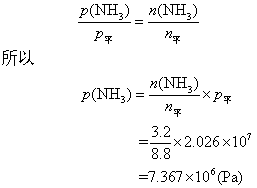
答 ❶ 平衡时容器内的压力是反应前压力的73.3%;
❷ 平衡时氨的分压是7.367×106Pa。