分子型氢化物的分解反应fenzixing qinghuawu defenjie fanying
非金属元素与氢元素组成的氢化物均为分子型化合物。它们在不同温度下可分解,生成非金属单质和氢气:
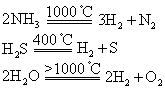
判断氢化物的稳定性可用以下方法:
❶ 氢化物的标准生成吉布斯函数的变化(△G )负,氢化物越易分解,反之则越难分解。这是由于(
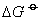 )的值越负时,该物质分解反应的平衡常数越大(
)的值越负时,该物质分解反应的平衡常数越大( ) ,反应的趋势越大。例如,氯化氢、碘化氢的
) ,反应的趋势越大。例如,氯化氢、碘化氢的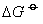 分别为-95.27 kJ·mol-1,1.30 kJ·mol-1,通过计算25℃时下列反应的平衡常数为
分别为-95.27 kJ·mol-1,1.30 kJ·mol-1,通过计算25℃时下列反应的平衡常数为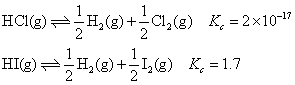 可知,在室温下氯化氢的分解趋势极小,而碘化氢则已开始分解。当温度升高时,△G 的值发生变化,氢化物分解反应的平衡常数一般均增大,使分解趋势加大。例如,氯化氢分解反应的平衡常数1000℃时增至5×10-5,3000℃时又增至1×10-2。
可知,在室温下氯化氢的分解趋势极小,而碘化氢则已开始分解。当温度升高时,△G 的值发生变化,氢化物分解反应的平衡常数一般均增大,使分解趋势加大。例如,氯化氢分解反应的平衡常数1000℃时增至5×10-5,3000℃时又增至1×10-2。❷非金属元素的电负性越大,它与氢元素电负性的差值越大,所形成的氢化物中化学键越牢,分子越稳定。例如,第二周期中,氮、氧、氟的电负性分别为3.0,3.5,4.0,氨气在800 ℃时开始分解,水在1000℃时开始分解,氟化氢高温下也很难分解。再如:ⅦA族的氯、溴、碘,电负性分别为3.0,2.8,2.5,它们的氢化物的分解温度分别为3 000 ℃,1 600℃,300 ℃。一般情况下,同周期非金属元素从左到右,同主族非金属元素自下而上,它们的氢化物越来越稳定。