惰性电子对效应duoxing dianzidui xiaoying
它是无机化合物中一个重要现象。它主要指p区的过渡后,具有ns2np0→6价电子构型的元素,如Ga,In,Tl;Ge,Sn,Pb;As,Sb,Bi等。其中的ns2电子对逐渐难以成键,容易形成+(n-2)低氧化态化合物,而其+n氧化态的化合物要么不易形成,否则就是不稳定(n为族数) 。这种化学现象是N.V.赛奇威克最早认识到的,并称为惰性电子对效应,也叫做s惰性电子对效应。根据高氧化态水化离子标准电极电势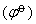 、高氧化态氧化物和卤化物分解热效应数据可以得出惰性电子对效应的周期性递变在同周期中一般从左至右增大,而在同族中并没有一条统一的规律,从第3至第4、第5至第6周期元素都是从上而下增大,并以第6周期元素为最大,即其低氧化态特别稳定。例如,具有6s2的Hg(0),Tl(Ⅰ),Pb(Ⅱ),Bi(Ⅲ)特别稳定。这表现为Hg(0)很难被氧化; 氯化亚铊比氯化铊稳定; 四氯化铅只有在193K时才能稳定存在,二氧化铅的氧化性很强(易变为Pb(Ⅱ)) ; 而铋酸钠甚至在硝酸中能将Mn2+氧化成MnO-4,Bi(Ⅴ)则还原成Bi(Ⅲ)。因而也叫做6s2电子对效应。而第2至第3,第4至第5周期之间除某些元素从上而下减小外,其余较难肯定。对于“隋性电子对效应”的解释很多,但均不甚完善。曾有人应用ns2电子的电离势之和的大小变化规律来说明第 6周期诸元素的低氧化态(n-2) 化合物较第5周期稳定得多的原因,但无法圆满地说明同一族中稳定性的有序变化。R.S.德拉歌认为若把惰性电子对效应归结为ns2电离势之和的增加,还不如把它归结为高氧化态化合物的平均热化学键能的降低。R.S.德拉哥还从结构上叙述了导致重元素成键能力减弱的主要因素:❶大原子的轨道重叠不好;
、高氧化态氧化物和卤化物分解热效应数据可以得出惰性电子对效应的周期性递变在同周期中一般从左至右增大,而在同族中并没有一条统一的规律,从第3至第4、第5至第6周期元素都是从上而下增大,并以第6周期元素为最大,即其低氧化态特别稳定。例如,具有6s2的Hg(0),Tl(Ⅰ),Pb(Ⅱ),Bi(Ⅲ)特别稳定。这表现为Hg(0)很难被氧化; 氯化亚铊比氯化铊稳定; 四氯化铅只有在193K时才能稳定存在,二氧化铅的氧化性很强(易变为Pb(Ⅱ)) ; 而铋酸钠甚至在硝酸中能将Mn2+氧化成MnO-4,Bi(Ⅴ)则还原成Bi(Ⅲ)。因而也叫做6s2电子对效应。而第2至第3,第4至第5周期之间除某些元素从上而下减小外,其余较难肯定。对于“隋性电子对效应”的解释很多,但均不甚完善。曾有人应用ns2电子的电离势之和的大小变化规律来说明第 6周期诸元素的低氧化态(n-2) 化合物较第5周期稳定得多的原因,但无法圆满地说明同一族中稳定性的有序变化。R.S.德拉歌认为若把惰性电子对效应归结为ns2电离势之和的增加,还不如把它归结为高氧化态化合物的平均热化学键能的降低。R.S.德拉哥还从结构上叙述了导致重元素成键能力减弱的主要因素:❶大原子的轨道重叠不好;
❷ 内层电子的斥力,特别在过渡元素后的Ga以及Tl和Pb中最为显著。目前对惰性电子对效应的说明,欠妥之处还有待于进一步研究。
- secondary emission
- Secondary era
- secondary modern school
- Second Empire
- Second Republic
- secretary bird
- secret pollice
- Secret Seryice,United States
- secret society
- securities
- Securities and Exchange Commission
- Security Council
- Sedan
- sedan chair
- Sedan,Battle of
- sedative
- Seddon,Richard John
- seder
- sedge
- Sedgemoor,Battle of
- sediment
- sedimentary rocks
- sedimentation
- sedum
- Seebeck effect