活化能与反应热的关系huohuaneng yu fanyingrede guanxi
对某可逆反应,由热力学结论,平衡常数KC随温度的变化关系为
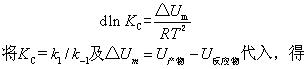
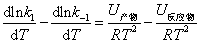
式中K1,K-1分别表示正、逆反应的速率常数。根据阿仑尼乌斯的观点,两个反应物分子碰撞,在变成产物之前需要经过一个活化态,反应物、产物和活化态的能量间的关系见下图。
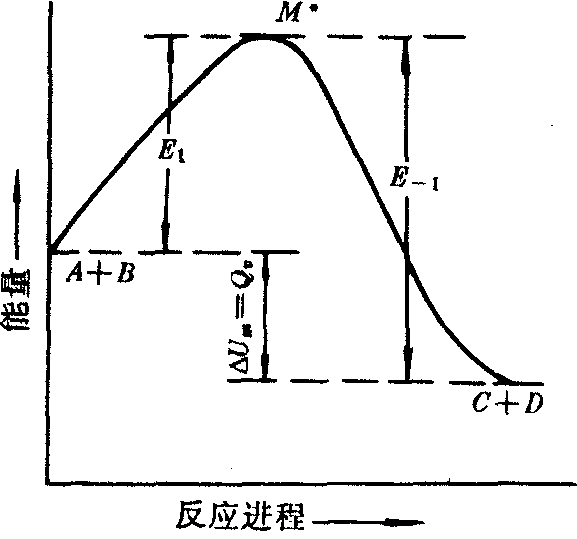
正、逆反应活化能与反应热的关系
E1为正向反应的活化能; E-1是逆反应的活化能。
根据阿仑尼乌斯经验式,对该可逆反应有
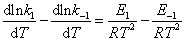
比较上述两式,可得
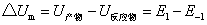
该式表明正、逆向反应活化能之差为反应的等容反应热△Um。若在反应温度不高的情况下,则等容反应热△U近似等于等压反应热△Hm,故
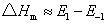
基元反应的活化能为正值。对正、逆向反应均为基元反应,如果反应为放热,即△Hm<0,由
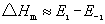
得知E1