活化能与温度的关系huohuaneng yu wendu deguanxi
一个化学反应的活化能,在不同温度时,其数值是不同的。经过双分子碰撞理论的数学处理,得出阈能Ec与阿仑尼乌斯活化能Ea有如下关系
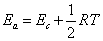
式中RT与气体分子的热运动有关,如理想气体,1mol分子的平均动能为3RT/2。从上式看,阈能Ec 与温度无关,阿仑尼乌斯活化能与温度有
关。但在温度变化不大的情况下,则Ec比1/2RT要大得多,1/2RT可以忽略,得出Ea≈Ec。同样,
从过渡态理论,亦可以得到双分子气相反应,阿仑尼乌斯活化能Ea与活化焓△H≠(近似可视为活化能E)有如下关系
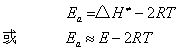
当温度变化不大时,2RT可以忽略,则Ea≈E。因此,在一般情况下 (温度变化不是很大时) 温度对反应速率的影响,无需考虑活化能随温度的改变,可把活化能视为定值来处理。