等压平衡式dengya pinghengshi
温度的变化主要是改变平衡常数的值,它对溶液浓度的影响完全可以忽略。由热力学原理知,平衡常数与反应标准自由焓变间的关系
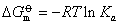
该式表示在一定温度下,平衡常数数值的大小完全由
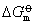 决定。而
决定。而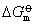 仅是温度的函数,与物质的量无关。因此,温度一定,Ka是个定值。说明平衡常数只与温度有关而与浓度或压力无关。经热力学的严格论证,平衡常数随温度的变化有如下关系
仅是温度的函数,与物质的量无关。因此,温度一定,Ka是个定值。说明平衡常数只与温度有关而与浓度或压力无关。经热力学的严格论证,平衡常数随温度的变化有如下关系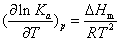
式中 Ka——平衡常数
△Hm——反应摩尔等压反应热T——温度R——气体常数
该式是J. H.范霍夫于1885年导出的,称范霍夫等压平衡式。
由上式可知,lnKa随温度的变化率决定于△Hm

平衡常数随温度升高而减小,说明升温对正向反应不利。若反应既不放热又不吸热,即△Hm=0,
