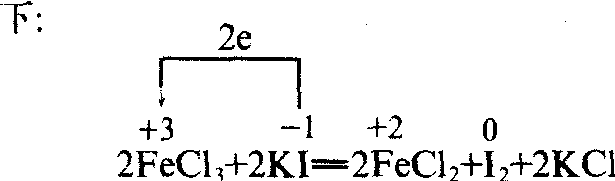氧化-还原反应yanghua-huanyuan fan ying
一种物质被氧化,同时另一种物质被还原的反应。对氧化-还原反应的认识分以下3个阶段:
❶从得、失氧观点认识 物质得氧的反应叫氧化反应,失氧的反应叫还原反应。
❷从元素化合价升、降观点认识 物质所含元素化合价升高的反应叫氧化反应,物质所含元素降低的反应叫还原反应。这种认识抓住了氧化-还原反应的表面特征,判断和分析反应时很方便; 不论反应中有无得、失氧的关系,都能通过化合价进行分析。
❸从电子得、失的观点认识 物质失去电子的反应叫氧化反应,物质得到电子的反应叫还原反应。这种认识揭示了氧化-还原反应的本质,根据物质得失电子的难易,可分析出物质的氧化性、还原性的强弱,从而判断反应是否发生。
掌握氧化-还原反应的一般方法: 首先分析元素化合价的变化,然后判断电子转移的方向,最后确定哪种物质 (元素或微粒) 发生了氧化反应,哪种物质(元素或微粒) 发生了还原反应。例如,氯化铁溶液和碘化钾溶液的反应,化合价变化及电子转移情况如