一氧化碳yiyanghuatan
也称为氧化碳 (Ⅱ),化学式CO。是一种无色气体,熔点为-199℃,沸点为-191.5℃,密度为1.250g·L-1 (室温),比空气略轻。它的结构式为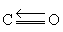 ,具有三键,与N2和CN-为等电子体,核间距dc-o=112.8pm,偶极距较小,为 0.4×10-30C· m,具有较高的离解能1071.6kJ·mol-1。一氧化碳在水中溶解得很少,25℃时溶解度为0.0026g,与水不发生化学作用,但易溶于乙醇。常态下,一氧化碳不活泼,高温时具有还原性,在适当高温下能将许多金属氧化物还原成金属:
,具有三键,与N2和CN-为等电子体,核间距dc-o=112.8pm,偶极距较小,为 0.4×10-30C· m,具有较高的离解能1071.6kJ·mol-1。一氧化碳在水中溶解得很少,25℃时溶解度为0.0026g,与水不发生化学作用,但易溶于乙醇。常态下,一氧化碳不活泼,高温时具有还原性,在适当高温下能将许多金属氧化物还原成金属:
CuO+CO=CO2+Cu
FeO+CO=CO2+Fe
2CO+O2=2CO2+566kJ
是常用的气态燃料。在阳光下或活性炭 (催化剂) 存在时,一氧化碳与氯直接化合,生成毒性很大的光气:CO+Cl2=COCl2
光气是一种重要的工业产品,用于制备许多有机和无机物质,如染料。加热时一氧化碳可被硫氧化:CO+S=COS
对于不活泼过渡元素化合物,如氯化钯,在水溶液中一氧化碳就可将其还原:PdCl2+CO+H2O=Pd+2HCl+CO2
反应后生成黑色金属钯,一氧化碳量甚微时,这一反应也非常明显,故可用此反应来鉴别它。一氧化碳是惰性氧化物或中性氧化物,但在高温高压下,仍可与苛性碱作用生成甲酸盐:
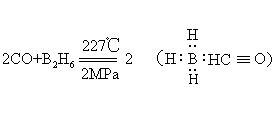
一氧化碳是发生炉煤气和水煤气的主要成分。实验室中可用浓硫酸与甲酸或草酸作用来制取少量一氧化碳,由草酸制得的产物中混有二氧化碳,可通过苛性钠溶液或石灰水来除去。温度高达400~500℃时碳燃烧可与所生成的二氧化碳反应生成一氧化碳,这在炼铁高炉及煤气发生炉中大量进行。一氧化碳毒性很大,特别危险的是它无味,人们在毫无知觉的情况下即已中毒,空气中只要有1/800 (体积) 的一氧化碳,就能使人在半小时内死亡。一氧化碳中毒即通称的煤气中毒,中毒原因是一氧化碳易与血液中的红血球形成配合物,使血色素失去载氧能力,使人致死。
利用一氧化碳的还原性还可除去烟道气中的二氧化硫,也用于高炉炼铁及其他冶金过程,高温高压下还能与氢催化结合成甲醇,这是工业上制备甲醇的主要方法之一。一氧化碳也为多种有机反应中间体,例如羰基合成可将不饱和烃转为醛,醛经催化氢化得醇,氧化得酸; 它与乙炔反应可生成丙烯酸,是有机合成中的重要原料。
一氧化碳Yiyanghuatan
碳不完全燃烧的产物。分子式CO,无色无味无臭的气体,微溶于水,比空气轻,标准状况下密度为1.25克/升。一氧化碳具有可燃性,是气体燃料发生炉煤气和水煤气的主要组成部分。一氧化碳在空气中燃烧时产生蓝色火焰,生成二氧化碳。2CO+O2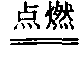 2CO2。一氧化碳有还原性,高温时能使金属氧化物还原为单质,因此在冶金工业上作还原剂。例如:氧化铜被还原 CuO+CO
2CO2。一氧化碳有还原性,高温时能使金属氧化物还原为单质,因此在冶金工业上作还原剂。例如:氧化铜被还原 CuO+CO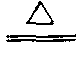 Cu+CO2,氧化铁被还原 Fe2O3+3CO
Cu+CO2,氧化铁被还原 Fe2O3+3CO 2Fe+3CO2。
2Fe+3CO2。
一氧化碳有剧毒,所谓“煤气中毒”就是一氧化碳中毒。吸入人体的一氧化碳和血液里的血红蛋白化合,使血红蛋白不能很好地与氧化合,人体就会缺少氧气,吸入少量一氧化碳,人就会头疼恶心,吸入较多一氧化碳时,人会由于缺氧而死亡。
一氧化碳
无色、无臭、可燃的有毒气体。1776年法国J.M.F.拉宋首先发现。一氧化碳是重要的化工原料,用于制取醋酸、甲醇、光气以及各种羰基化合物等约占总产量80%以上。还有20%以下用于冶金工业。一氧化碳剧毒,在工作环境中最大允许含量为30 mg/m3。人对一氧化碳最大耐受浓度为650 mg/kg(45 min内)。人在60~90 min内吸入一氧化碳1600~2000 mg/kg即可危及生命,2~15 min内吸入量达5000~10000 mg/kg即可死亡。