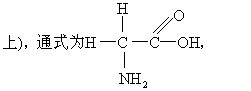
氨基酸anjisuan
羧酸分子中烃基上的氢原子被氨基取代的化合物,已知的氨基酸有数百种,但在生物体内,作为蛋白质合成原料的氨基酸主要有20种(见表),它们均为α-氨基酸 (氨基连在羧基的α-碳
20种α-氨基酸除甘氨酸外,都具有旋光性,它们的α-碳原子是手性碳原子,构型均为L-型。在20种氨基酸中,有8种人体不能制造,必须由食物中获得,称为必需氨基酸,其中赖氨酸在植物性食物中含量较少,常添加赖氨酸制造强化食品以满足病人和儿童的需要 (见下表)。
氨基酸分子中有氨基,也叫羧基,具有胺类与羧酸类的通性。氨基酸是两性化合物,遇强碱生成羧酸盐,遇强酸生成铵盐。当加酸或加碱至氨基与羧基的离子化程度相等时,溶液的pH值叫做氨基酸的等电点。在等电点,氨基酸以两性离子存在,例如甘氨酸的两性离子为H3N—CH2—COO-。呈两性离子时,氨基酸的溶解度最小。氯基酸在晶体中也以两性离子存在,因此,氨基酸晶体具有较高的熔点。
α-氨基酸是蛋白质和多肽水解反应的最终产物。α-氨基酸与水合茚三酮在碱性溶液中加热,可形成紫蓝色物质,但脯氨酸无此反应:
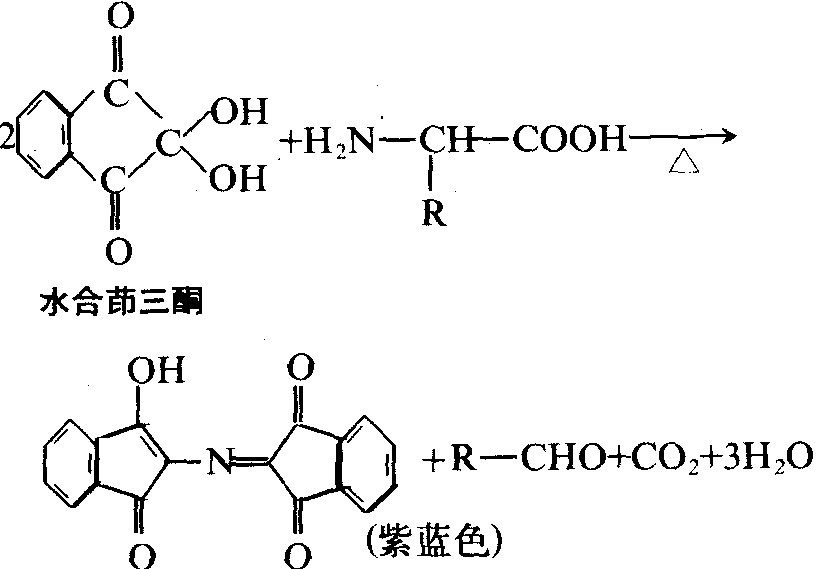
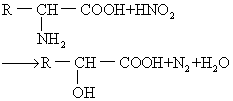
α-氨基酸除作为营养品和药物外,还是重要的化工原料。谷氨酸-钠盐俗称味精,是常用的调味剂。
氨基酸anjisuan
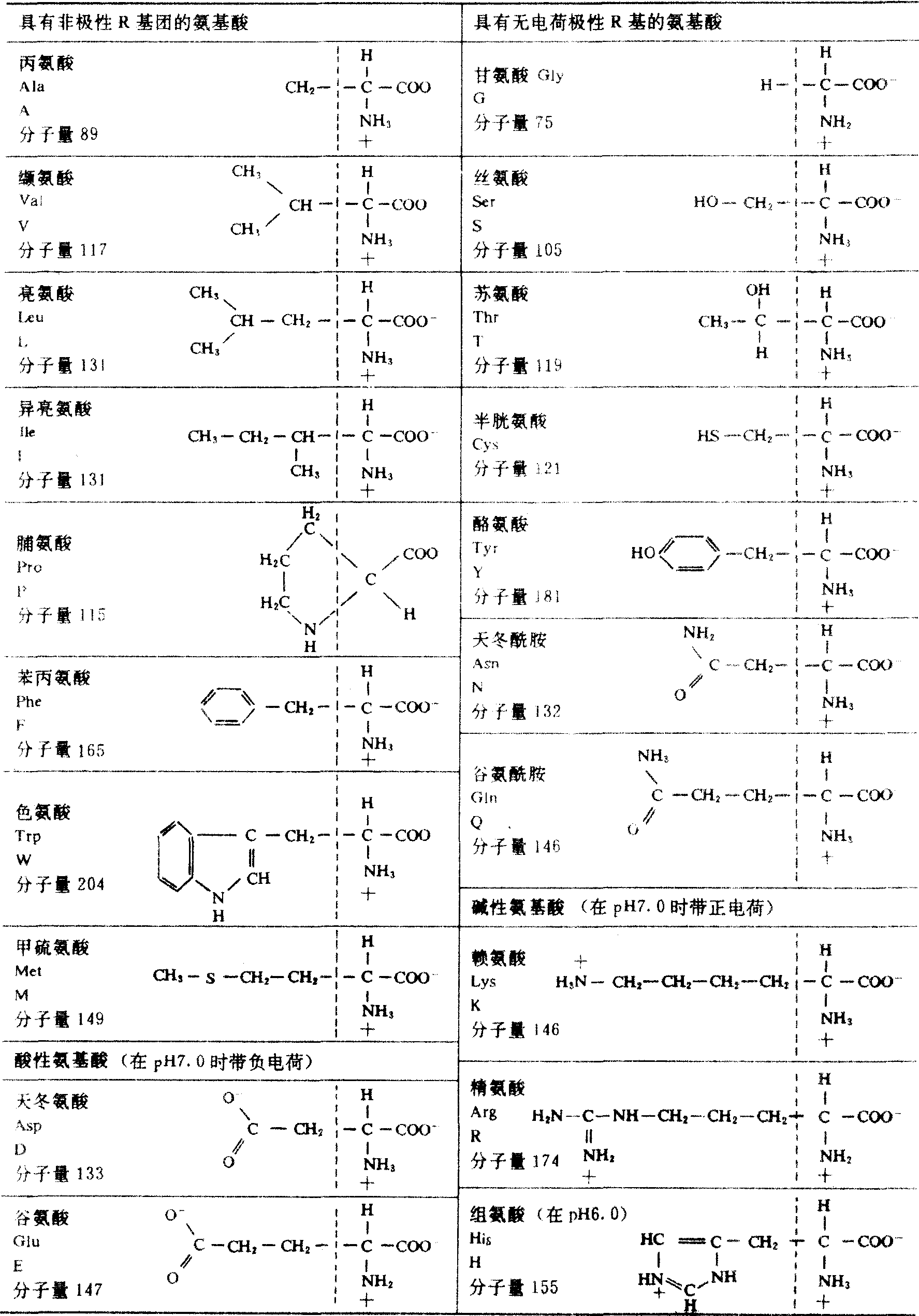
含有氨基的羧酸都是氨基酸,但在生物体中存在的氨基酸种类不多。组成天然蛋白质基本结构的氨基酸共有20种。这些氨基酸都是α-碳氨基酸,即氨基和羧基都连在同一个α-碳原子上。α-碳原子还连接1个氢原子和1个侧链基团。侧链基团通常用R表示。20种氨基酸的R基都不相同。氨基酸在生理pH(约为7)时为离子式,其通式是:从式中可看出,除R=H(甘氨酸)外,氨基酸的α-碳原子是手征性(不对称)碳原子,是分子的不对称中心,它连接着4个不同的原子或基团。因此,除甘氨酸外,所有α-氨基酸均为旋光活性物质。一般用构型表示手征性碳原子周围4个原子或原子团在空间排布的立体关系,而将手征性化合物分成D-型和L-型两种异构体。规定以甘油醛为参考化合物,将甘油醛的醛基写在分子的顶端,则手征性碳原子周围的原子或原子团有两种排布方式:羟基在碳原子右边的叫D-甘油醛,在左边的叫L-甘油醛。参照甘油醛的构型,将α-氨基酸的羧基写在分子的顶端,则氨基在手征性碳原子右边的是D-氨基酸,在左边的是L-氨基酸。氨基酸的构型与其旋光性质没有一定的关系,有的L-氨基酸使偏振光平面向左旋转,为左旋体;另外一些L-氨基酸能使偏振光平面向右旋转,为右旋体。天然蛋白质中的氨基酸单位都是L-氨基酸,生物中虽也存在某些D-氨基酸,但它们不是蛋白质的成分。构成蛋白质的20种基本氨基酸有不同的R基,因此可以根据R基的性质,特别是其极性分类。氨基酸的R基的极性变化很大,这里所谓的极性实际指的是在生理pH时与水(典型的极性分子)作用的趋势。R基可从非极性或疏水R基变化到高极性亲水R基。据此,可将氨基酸分为4大类。每种氨基酸有一国际通用的3字母或1字母符号,现将这20种氨基酸的名称、结构式(另表示R基)及缩写符号列成一表(见下页)。α-氨基酸为无色晶体,熔点较高。一般能溶于水、稀酸或稀碱,但不溶于有机溶剂。氨基酸的α-氨基、α-羧基和其侧链的功能基都有特征性化学反应,如氨基可以乙酰化,羧基可以酯化等。有一个在检出、测量和鉴定氨基酸中得到广泛应用的方法,是利用它们与茚三酮的反应,所有具有自由α-氨基的氨基酸与过量茚三酮共热时,产生紫色化合物,而α-氨基被取代的脯氨酸则产生黄色。在合适的条件下,颜色的深度反映氨基酸的浓度,可以定量测定。氨基酸的主要功能是合成蛋白质,因此生物体中的氨基酸不但数量要足,品种要齐全,而且比例要适当。人和动物体内的氨基酸,可来自食物蛋白质在消化道内消化(酶水解)后被吸收的氨基酸,也可来自组织蛋白质的分解。植物与微生物的营养类型与动物不同,但其细胞内的蛋白质在代谢时仍然需要先行水解。某些氨基酸在人和动物体内可以相互转化或由其他物质转变而来,但人和动物不能合成全部氨基酸。不能生物合成的那些氨基酸叫做必需氨基酸。人有8种必需氨基酸,它们是:赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、亮氨酸、异亮氨酸及缬氨酸。这类氨基酸必须由食物,主要是蛋白质供给。动物蛋白质的营养价值一般比植物蛋白质高些,这是因为前者所含的必需氨基酸的组成和比例,都比较合乎人体的需要。食品种类多样化,可以互相补充,提高蛋白质的营养价值。如谷类蛋白质含赖氨酸较少,而色氨酸含量相对多些,豆类蛋白质含赖氨酸较多,而色氨酸较少,把这两种蛋白质混合食用,恰好补充了彼此的不足。
除组成天然蛋白质基本结构的20种氨基酸外,还发现几种特殊的其他氨基酸是某些特种蛋白质的成分。每种特殊氨基酸都是20种基本氨基酸中某种氨基酸的衍生物,都是在其母体氨基酸参入多肽链后经酶促修饰生产的。例如4-羟基脯氨酸、5-羟基赖氨酸、N-甲基赖氨、γ-羰基谷氨酸,锁链素和异锁链素等(左方列出其中2种的结构式,可见它们分别是某种氨基酸的衍生物)。
现将几种特殊氨基酸及其存在列表说明如下:

氨 基 酸 的 分 类
氨基酸amino acids
羧酸烃链上的氢原子被氨基取代所生成的衍生物。氨基酸是蛋白质的基本结构单位。天然蛋白质的构成氨基酸通常有20种。除脯氨酸外,这些氨基酸均为α-氨基酸。其结构式为:
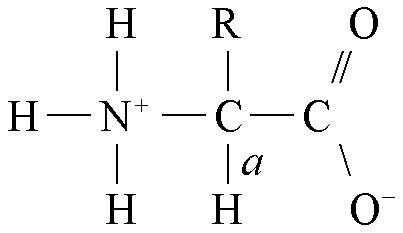
结构 按照α-氨基酸中侧链R基的极性性质,组成蛋白质的20种常见氨基酸可分4组: ❶R基为非极性的氨基酸。共有8种,5种带有脂肪族侧链,即丙氨酸、亮氨酸、异亮氨酸、缬氨酸和脯氨酸,2种为芳香族氨基酸,即苯丙氨酸和色氨酸,一种为含硫氨基酸,即甲硫氨酸;本组氨基酸在水中的溶解度比极性R基氨基酸小;脯氨酸与一般α-氨基酸不同,它是α-氨基酸上的侧链取代了氨基酸上的一个氢原子所形成的,实际上是亚氨基酸。
❷R基有极性但不具有电荷的氨基酸。共有7种,即R基有羟基的丝氨酸、苏氨酸和酪氨酸,R基有巯基的半胱氨酸,R基有酰胺基的谷氨酰胺和天冬酰胺,另一种氨基酸为甘氨酸; 甘氨酸分子无R基,但具有一定的极性,故归于本组; 本组氨基酸侧链中含有不解离的极性基,能与水形成氢键,较易溶于水。
❸R基带正电荷的氨基酸。共有3种,即赖氨酸、精氨酸和组氨酸; 在pH7.0时携带正电荷,也称碱性氨基酸。
❹R基为带负电荷的氨基酸。共有2种,即谷氨酸和天冬氨酸; 在pH7.0时分子带负电荷,也称酸性氨基酸。20种氨基酸的结构式,缩写符号和有关常数见表。除上述20种常见的氨基酸外,尚有二碘酪氨酸、甲状腺素、羟脯氨酸、羟赖氨酸等见于某些蛋白质中。除了参与蛋白质组成的氨基酸外,还在各种组织和细胞中找到200多种其他氨基酸,这些氨基酸大多是组成蛋白质的那些α-氨基酸的衍生物。但是,有一些是β-、γ-或δ-氨基酸,并且有些是D型的氨基酸,如β-丙氨酸、γ-氨基丁酸以及在抗生素短杆菌肽-S中的苯丙氨酸、革兰阳性细菌细胞壁中的D-丙氨酸和D-谷氨酸。有些非蛋白氨基酸在代谢上作为重要的前体或中间产物,其中β-丙氨酸是维生素泛酸的前体,瓜氨酸及鸟氨酸是合成精氨酸的前体,γ-氨基丁酸是神经传导的化学物质。植物含有非常多的非蛋白氨基酸,属于植物次生物质,如茶氨酸、南氨酸、刀豆氨酸、黎豆氨酸和β-氰丙氨酸等。
性质 除甘氨酸外,所有α-氨基酸中的α-碳原子是一个不对称碳原子,因此具有旋光性。氨基酸的旋光符号和大小取决于它的R基性质,并且与测定时溶液pH有关。参与蛋白质组成的20种氨基酸中,酪氨酸、色氨酸和苯丙氨酸具有光吸收能力,这是利用紫外分光光度法(在波长280nm处)测定蛋白质浓度的基础。氨
蛋白质中常见氨基酸的结构、pKa值和pI值
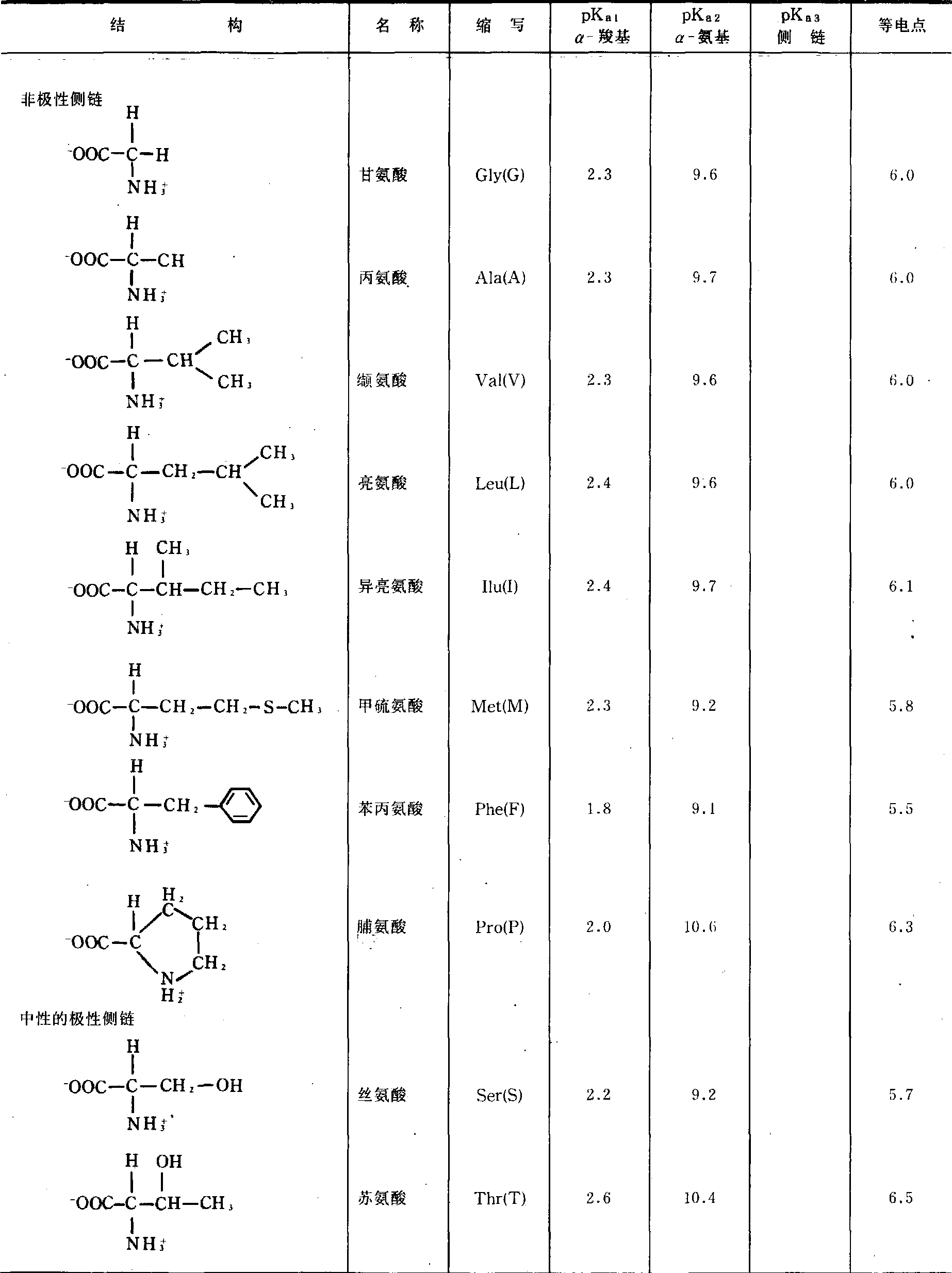
(续表)

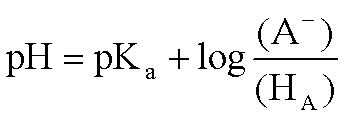
作为两性电解质的氨基酸,可解离基团的存在状态是与溶液pH有关的。氨基酸净电荷为零时,其溶液的pH即为该氨基酸的等电点,即pI。单氨基、单羧基氨基酸的pI由下列关系式确定:
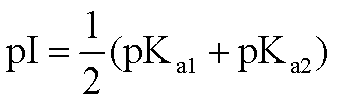
反应 氨基酸的氨基可与强氧化剂亚硝酸起反应,放出氮气,这是定量测定氨基酸中α-氨基的重要反应。氨基酸的氨基与酰化试剂 (酰酐) 在碱性溶液中作用时,氨基可被酰化。氨基可与水合茚三酮作用而生成紫色化合物,两个亚氨基酸-脯氨酸与水合茚三酮反应形成黄色化合物。水合茚三酮反应广泛地用于氨基酸的定量测定。氨基酸的α-氨基与2,4-二硝基氟苯(DNFB)在弱碱性溶液中作用生成二硝基苯氨基酸,用此反应可鉴定多肽链的氨基。另外,利用α-氨基与异硫氰酸苯酯的化学反应可进行多肽和蛋白质中氨基酸顺序分析。氨基酸的羧基能与醇类化合物发生酯化反应,也可经化学的或生物学的脱羧反应,形成相应的胺类化合物。个别氨基酸的颜色反应可用于这些氨基酸的定性和定量分析。常用的有米伦氏反应——当酚化合物与Hg(NO3)2共热使呈红色,含有酪氨酸的蛋白质都有此反应; 坂口反应——在碱性溶液中,胍基与含有α-萘基和次氯酸钠的试剂反应呈红色,精氨酸及含有精氨酸的蛋白质均有此反应; 亚硝基亚铁氰酸盐试验——半胱氨酸及含有自由巯基的蛋白质,在稀氨溶液中能与亚硝基亚铁氰酸钠〔Na2(NO)Fe-(CH)5·2H2O〕反应呈红色; 乙醛酸反应——吲哚衍生物与一些芳香乙醛反应产生有色物质,该反应可用于定量测定蛋白质中的色氨酸; Pauly反应——在碱性溶液中,组氨酸和酪氨酸与重氮化的磺氨酸偶联呈红色; 醋酸铅反应——二硫键或巯基与醋酸铅可反应生成黑色的硫化铅沉淀,此反应可检测蛋白质中的半胱氨酸和胱氨酸。
氨基酸Anjisuan
分子中含有氨基(-NH2)和羧基(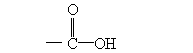 )两种基团的化合物。作为蛋白质合成原料的氨基酸有20种,例如:
)两种基团的化合物。作为蛋白质合成原料的氨基酸有20种,例如:
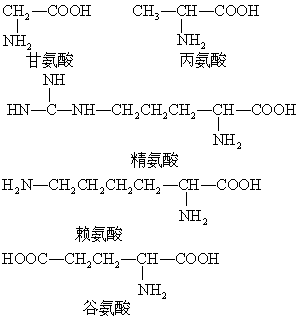
这20种氨基酸均为无色晶体,熔点较高,易溶于水。氨基酸具有两性,可以与强碱形成盐:

也可以与强酸形成盐:
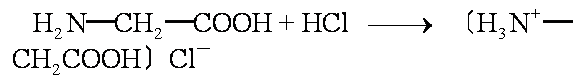
在一定酸碱性下,氨基酸形成内盐(两性离子)如甘氨酸的两性离子为:
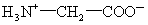
蛋白质的最终水解产物是氨基酸,其中8种(如赖氨酸)是人体不能制造的,必须由食物中摄取。谷氨酸—钠盐俗称味精,是常用的鲜味剂。
氨基酸
一些含有氨基的有机酸。组成蛋白质的基本结构单位。蛋白质水解后可得到20种氨基酸,它们的通式为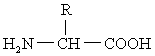 除脯氨酸外,在其α-碳原子上都有一个自由的羧基及一个自由的氨基。各种氨基酸之间在结构上的差异都表现在R基因上。它具有D和L两种构型,天然蛋白质中的都属L型,除甘氨酸外都有旋光性。依其酸碱性分为中性、碱性和酸性氨基酸;以极性区分可分为极性和非极性氨基酸。
除脯氨酸外,在其α-碳原子上都有一个自由的羧基及一个自由的氨基。各种氨基酸之间在结构上的差异都表现在R基因上。它具有D和L两种构型,天然蛋白质中的都属L型,除甘氨酸外都有旋光性。依其酸碱性分为中性、碱性和酸性氨基酸;以极性区分可分为极性和非极性氨基酸。
氨基酸amino acid
羧酸烃链上的氢原子被氨基取代所生成的衍生物。是蛋白质的基本结构单位。大多由蛋白质水解制得,少数来自化学合成或微生物发酵。天然蛋白质中存在的20种氨基酸中,除甘氨酸外都是L-型氨基酸;除脯氨酸外,均为α-氨基酸。结构通式为![]() ,其中R为不同的取代基。按取代基的种类或极性不同,可分为脂肪族、芳香族和杂环氨基酸或极性和非极性氨基酸。熔点高,溶于水成两性离子。不吸收可见光,但酪氨酸、色氨酸、苯丙氨酸能吸收紫外光。除脯氨酸与茚三酮反应生成黄色物质外,均生成蓝紫色物质。是生物体内合成许多其他重要物质(如激素、嘌呤、嘧啶、卟啉、一些维生素和次生代谢物等)的前体。还有一些氨基酸,如β-丙氨酸、刀豆氨酸等,虽不是蛋白质的组成成分,但在生命活动中有重要作用。人体或动物所需的氨基酸中,有些必须从食物中提供,称为必需氨基酸;有些可从其他氨基酸或其他有机物转化而来,称为非必需氨基酸。
,其中R为不同的取代基。按取代基的种类或极性不同,可分为脂肪族、芳香族和杂环氨基酸或极性和非极性氨基酸。熔点高,溶于水成两性离子。不吸收可见光,但酪氨酸、色氨酸、苯丙氨酸能吸收紫外光。除脯氨酸与茚三酮反应生成黄色物质外,均生成蓝紫色物质。是生物体内合成许多其他重要物质(如激素、嘌呤、嘧啶、卟啉、一些维生素和次生代谢物等)的前体。还有一些氨基酸,如β-丙氨酸、刀豆氨酸等,虽不是蛋白质的组成成分,但在生命活动中有重要作用。人体或动物所需的氨基酸中,有些必须从食物中提供,称为必需氨基酸;有些可从其他氨基酸或其他有机物转化而来,称为非必需氨基酸。
氨基酸
含有氨基的羧酸。构成蛋白质的基本单位。组成天然蛋白质分子的氨基酸有20种。按照α-氨基酸中侧链R基的极性性质分为4组:R基为非极性的氨基酸,共有8种;R基有极性但不具有电荷的氨基酸,共7种;R基带正电荷的氨基酸,共3种;R基为带负电荷的氨基酸,共2种。人体必须从食物中摄取的氨基酸共8种:蛋氨酸、缬氨酸、亮氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸和苯丙氨酸。