斯莱脱规则silaituo guize
估算屏蔽常数σ,计算原子轨道相对能量的经验规则。J.G.斯莱脱根据光谱数据,归纳出如下一套规则,先将原子中电子按下列状态分为轨道组:
(1s)(2s,2p)(3s,3p)(3d)(4s.4p)(4d)(4f)(5s,5p)(5d)余类推,这些组被认为是从核向外依次排列的。
❶在所考虑的轨道外面的轨道组。为零,可以近似地认为外轨道组电子对内轨道组电子没有屏蔽作用。
❷与所考虑的同一轨道组的电子间的。为0.35(1s组除外,它是0.30)。
❸如果被屏蔽的电子为ns或np时,低一主量子数的每个电子的。为0.85,而离核更近的组上的电子的σ则为1.00e
❹如果被屏蔽电子为nd或nf电子时,则位干它左边各轨道组电子对它们的σ均为I .00.
由此可算出原子中其他电子对某个电子的a值,从而计算出对该电子相应的有效核电荷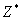 的值。例如,在基态钾原子中,核电荷Z为19,核外电子分组如下:(ls)2(2s2p)8(3s3p)8(3d)0(4s)1
的值。例如,在基态钾原子中,核电荷Z为19,核外电子分组如下:(ls)2(2s2p)8(3s3p)8(3d)0(4s)1
对价层4s电子的Eσ值,可计算如下:
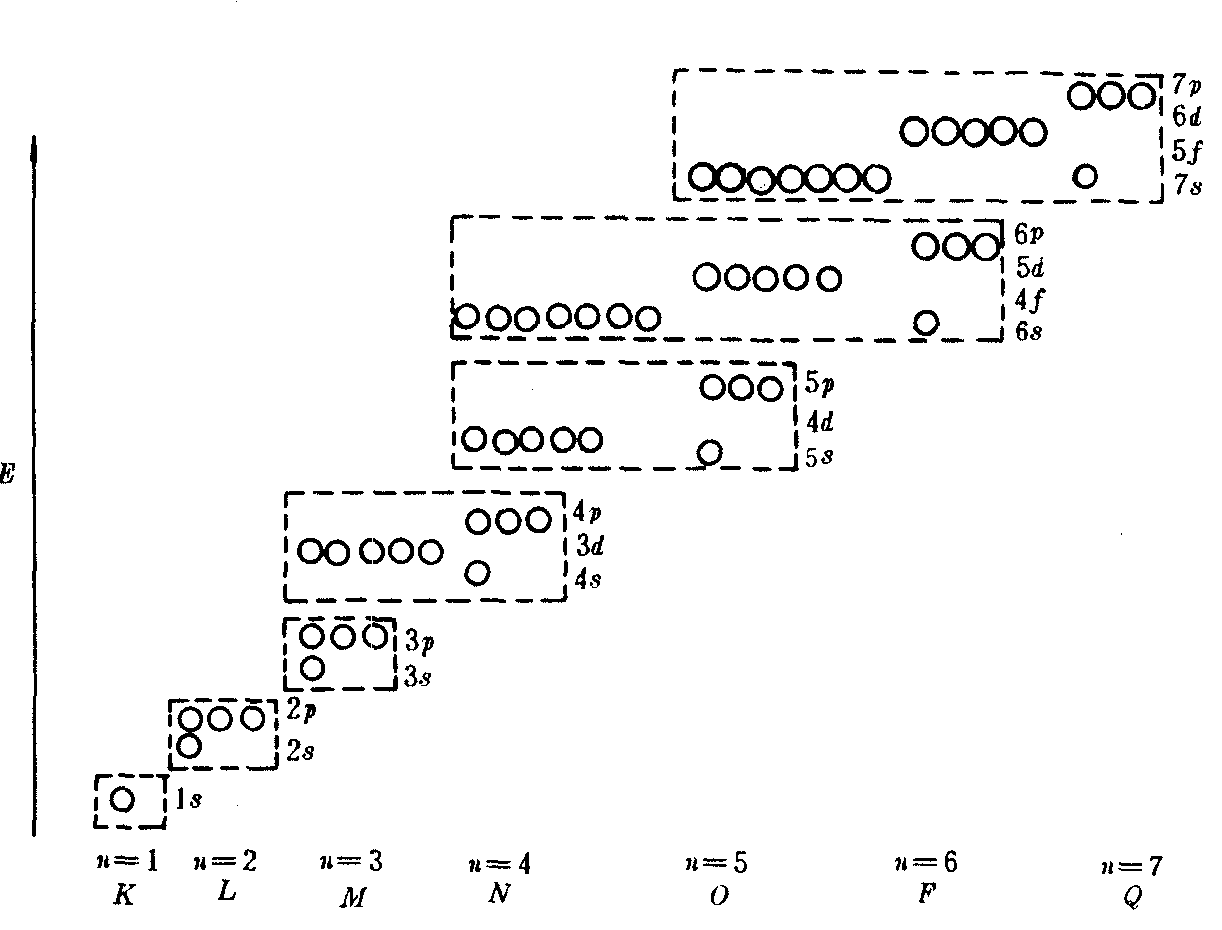
图1 原子轨道的近似能级图(鲍林)

对于一个3d电子,
Σσ= (5×0.35)+ (18×1.0)=19.75
∴Z*=26-19.75=6.25
因为Z*大时核对该电子的吸引大,能量低,所以结果表明,当3d轨道上已填有电子时,4s能级高于3d能级。我国化学家徐光宪在50年代总结归纳出核外电子能级相对高低与主量子数n和角量子数l关系的简便公式,对基态原子填充电子时按n+0.7l计算,对基态原子丢失电子时按n+0.4l计算。公式所得的结果与斯莱脱规则一致。